Перов О.И.,1 Горин С. Г.,1 Бугровская О. И.,1 Атаманчук А.А.,2 Хосровян А.М.,1 1ГБУЗ «Госпиталь для ветеранов войн № 2 Департамента здравоохранения г.Москвы», Россия, 109472, г. Москва, Волгоградский проспект д.168 2 Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского, Россия, 129110, г. Москва, ул. Щепкина, д. 61/2
Авторы: Перов Олег Иванович врач анестезиолог-реаниматолог ГБУЗ «Госпиталь для ветеранов войн № 2 Департамента здравоохранения г. Москвы». Ser2641@yandex.ru Атаманчук Алексей Алексеевич врач-терапевт ГБУЗ МО МОНИКИ им М.Ф.Владимирского zoroastr123@mail.ru
Резюме: В статье описано клиническое наблюдение мультиморбидной пациентки с пневмонией тяжелой степени, полиорганной недостаточностью на фоне синдрома ожирения альвеолярной гиповентиляции. Показан пример успешного лечения с применением шлема неинвазивной вентиляции легких шлемом StarMed CaStar R в условиях открытой трахеостомы и успешной профилактики наиболее частых осложнений, связанных с длительной ИВЛ.
Ключевые слова: Синдром Пиквика; синдром ожирения – гиповентиляции, НИВЛ; шлем StarMed CaStar R; ожирение, пневмония, клиническое наблюдение.
Введение
Одной из наиболее актуальных проблем современного общества, с учетом высокой значимости социальных и медицинских последствий является ожирение. По данным эпидемиологического исследования средняя распространенность ожирения среди населения в России составляет 24%, в возрастной группе 25-64 лет – 29,7%. Под ожирением в настоящее время принято считать хроническое мультифакторное гетерогенное заболевание, проявляющееся избыточным образованием жировой ткани, прогрессирующее при естественном течении, как правило, имеющее высокий кардиометаболический риск, специфические осложнения и ассоциированные с ним сопутствующие заболевания. В приведенном определении отражена существенная роль ожирения в генезе гипертонической болезни, синдрома обструктивного апноэ сна (СОАС), сахарного диабета 2-го типа, ИБС, и об этом свидетельствуют также многочисленные научные исследования.
Одной из наиболее тяжелых клинических форм этого заболевания принято считать синдром ожирения гиповентиляции (СОГ), исторически получило название синдрома Пиквика (Пиквикский синдром). Название «пиквикский» вошло в историю медицины из романа Чарльза Диккенса «Посмертные записки Пиквикского клуба». Впервые в 1918 году для обозначения пациента страдающего ожирением и гиперсомнией наименование “Пиквикский” применил выдающийся британский врач и ученный Уильям Ослер. Спустя 40 лет доктор Burwel с коллегами опубликовали клиническое наблюдение пациента, страдающего выраженным ожирением ассоциированным с альвеолярной гиповентиляцией, хронической дыхательной недостаточностью, полицитемией и признаками хронического легочного сердца, определенное ими как «Пиквикский синдром». В дальнейшем с развитием медицинской науки Jung и Kuhl обнаружили при ПС наличие тяжелой формы СОАС.Точное количество лиц страдающих ПС неизвестно, но среди пациентов с ожирением и СОАС доля больных страдающих ПС составляет около 10%.
Этиология развития ПС до конца не установлена, но существуют весомые аргументы в пользу его мультифакториальности. Признана значимой в его генезе роль полиморфизмов различных генов в сочетании с алиментарным фактором. В основе патофизиологических эффектов ПС лежит чрезмерное ожирение, приводящее к выраженному сужению верхних дыхательных путей и инспираторному глоточному коллапсу их во время сна проявляющимся тяжелым СОАС, а также к снижению вентиляционной функции при отсутствии органического поражения легких. Нарушение вентиляции легких при ПС обуславливается механическим затруднением экскурсии диафрагмы и стенки грудной клетки вследствие массивного отложения жировой ткани. Доказано также, падение максимального давления на выдохе из-за снижения силы дыхательных мышц. Мышечная слабость при МО объясняется уменьшением податливости грудной клетки вследствие избыточного отложения жировой ткани в ней. Тяжелые формы СОАС приводят к постоянной дневной сонливости, что у водителей автотранспорта страдающих ПС приводит к засыпанию за рулем и повышению количества ДТП. Нарушения вентиляции ведут к развитию гипоксии и гиперкапнии, усугубляющимся во время ночного сна. Указанные нарушения вызывают развитие и прогрессирование сердечной и дыхательной недостаточностей, возникновению нарушений сердечного ритма, легочной гипертензией, приводящей к формированию легочного сердца. Без лечения смертность при СОГ составляет около 70%.
Клиническое наблюдение
Пациентка Т. 70 лет, пенсионерка, доставлена в ГБУЗ «Госпиталь для ветеранов войн № 2 департамента здравоохранения г. Москвы» (ГВВ № 2) для плановой госпитализации в нефрологическое отделение. При осмотре пациентки в приемном отделении диагностирован синдром острой дыхательной недостаточности, осмотрена реаниматологом, по тяжести состояния была переведена в отделение реанимации и интенсивной терапии (ОРИТ).
При поступлении предъявляла жалобы: на нарастание отеков, одышку смешанного характера в покое, усиливающуюся при физической нагрузке, быструю утомляемость и постоянную сонливость на протяжении дня, отеки нижних конечностей, частый (до 7 раз/сутки) жидкий стул.
Из анамнеза: свыше 20 лет страдает гипертонической болезнью, ИБС, сахарным диабетом 2-го типа – 10 лет. Наблюдалась терапевтом, эндокринологом, кардиологом в поликлинике, по месту жительства. Назначенные препараты принимала нерегулярно, предписанной диеты не придерживалась. В течение последних пяти лет пациентка неоднократно находилась на стационарном лечении по поводу декомпенсации углеводного обмена и хронической сердечной недостаточности. Настоящее ухудшение своего состояния пациентка связывала с психоэмоциональным стрессом, что вызвало резкую прибавку в весе на 30 кг, за несколько последних месяцев. В виду интенсивного прогрессирования одышки, нарастания отеков, снижения диуреза до олигоанурии, пациентка экстренно госпитализирована в ОРИТ одной из московских клиник. Там проводилась интенсивная терапия: неинвазивная вентиляция легких (НИВЛ), 3 сеанса гемодиафильтрации. На фоне проводимого лечения состояние с положительной динамикой: уменьшение дыхательной недостаточности, начало разрешения явлений ОПП. Спустя неделю, пациентка была переведена в терапевтическое отделение, где продолжена была консервативная терапия (торсемид 5 мг/сут утр, цефтриаксон 2 гр в/м каждые 12 часов, бисопролол 5 мг утром, эналаприла малеат по 10 мг утром и вечером). В отделении отмечено появление частого жидкого стула до 7 раз в сутки.
После проведенного лечения больная была выписана домой. В тот же день пациентка госпитализирована в плановом порядке в ГВВ №2 для дальнейшего лечения в условиях нефрологического отделения.
Состояние при поступлении: тяжелое. Масса тела 165 кг, рост 164 см, индекс массы тела – 61,35 кг/м2.Кожа лица гиперемирована, умеренный цианоз губ. Пастозность голеней и стоп. Пролежни обеих пяток. Уровень сознания 15 баллов по шкале комы Глазго (ШКГ). Дыхание самостоятельное, ослабленное под обеими лопатками, больше справа. Число дыханий до 20 в мин. SрО2 87%, при инсуффляции О2 4 – 6 л/мин, SрО2 – 96%. ЧСС – 86 в мин, АД – 140/80 мм.рт.ст. Живот увеличен в размерах за счет подкожно жировой клетчатки. Отмечается многократный жидкий стул. Мочеиспускание по уретральному катетеру, темп диуреза 150 мл в час на фоне остаточного действия петлевых диуретиков.
При лабораторно-инструментальном исследовании выявлено:
- Тест на Toxini A Clostridii difficili, антиген – “положительный”.
- Клинический анализ крови: Hb – 96 г/л , Ht – 34.8 %, эритроциты – 3.98х1012/л, лейкоциты – 6.36х109/л, нейтрофилы – 71.7 % , тромбоциты – 122х109/л.
- Биохимический анализ крови: общий белок – 55г/л, мочевина – 15 ммоль/л, креатинин – 173 мкмоль/л, общий биллирубин – 9,5 мкмоль/л, АLТ – 11ед/л, АSТ – 11ед/л, Ca – 1,8ммоль/л, глюкоза – 4,2 ммоль/л.
- Коагулограмма: фибриноген – 3,06г/л, ПТИ – 72%, МНО – 1,32, АЧТВ – 23 сек,
- КЩС: рН -7.47, рСО2-55.9ммрт.cт., рО2 – 95.1ммрт. cт., ВЕ (Е) -14.5ммоль/л, К-3.43 ммоль/л. Na-136.1ммоль/л, лактат – 1.43ммоль/л, Nа – 134ммоль, К – 3,48ммоль/л.
- Электрокардиограмма – синусовый ритм, блокада передней ветви левой ножки пучка Гиса, желудочковая экстрасистолия.
- ЭХО-КГ: Симметричная гипертрофия миокарда левого желудочка. Дилатация левого предсердия и правого предсердия. Локальная сократимость миокарда не нарушена. Диастолическая дисфункция миокарда левого желудочка 1 типа. Диаметр нижней полой вены 20 мм.
Рентгенография органов грудной клетки:
Рентгенограмма 1а
В легких определяется венозное полнокровие, эмфизема с обеих сторон. Гомогенное затемнение легочных полей больше слева за счет наличия жидкости в плевральных полостях и неоднородная инфильтрация на фоне жидкости. Куполы диафрагмы не дифференцируются, срединные тени расширены.
Рентгенограмма 1б
На Rg контроле динамика в положительную сторонуколичество жидкости в плевральных полостях уменьшилось справа дифференцируется купол диафрагмы. Прозрачность легочных полей стала больше за счет рассасывания инфильтрации.
Рис 1. Rg ОГК больной К.
После осмотра и дообследования выставлен предварительный диагноз: Синдром ожирения –гиповентиляции (с-м Пиквика). Нозокомиальная двухсторонняя нижнедолевая пневмония, тяжелой степени тяжести, правосторонний гидроторакс. Псевдомембранозный колит. Сахарный диабет 2 тип. Гипертоническая болезнь 2 ст, АГ3 ст, риск сердечно сосудистых осложнений 4. ИБС: атеросклеротический кардиосклероз. ОПП на фоне хронической болезни почек С3. Недостаточность кровообращения 2Б, острая дыхательная недостаточность.
Состояние пациентки оставалось тяжелым, с отрицательной динамикой. По тяжести состояния больная переведена в ОРИТ. Уровень сознания по ШКГ 10 сопор. Шкала SOFA 6 баллов. рО2 100 ммHg. рСО2 55 мм. Инсуффляция О2 6л в мин. Сердечные тоны приглушены ритмичны ЧСС 110-120уд в мин АД 115/70 Hg на фоне инфузии допамина 8-10мкг/кг в мин, доза титровалась. ЦВД 200мм Н2О. Ввиду прогрессирования полиорганной недостаточности (ПОН) (дыхательной, сердечно-сосудистой, церебральной, почечной) произведена интубация с трахеи, осуществлен перевод на ИВЛ респиратором «Engstrоng» в режиме SIMV – РS, с заданными параметрами вентиляции I:Е=1:2, ЧДД – 8 в мин. РЕЕР 6см H2O, PS – 10 см H2O, Fi О2 – 40%, I:Е=2:1, при этом ДО-500 – 550 мл,PIP-18 см H2O,Pcр – 11см H2O, SрО294% ЧД 16-18 в мин.рО2 100 ммHg. рСО2 50 ммHg, Oxygenation Index (OI) 220.
Шкала комы Глазго считается «золотым стандартом» в градации глубины комы, но оценить речевую реакцию у интубированных больных с ее помощью не представляется возможным, поэтому после интубации оценка уровня сознания проводилась нами по шкале Full Qutline of UnResponiveness (FOUR) и составила 10 балов (сопор). Следует заметить, что первоначально нами рассматривалась НИВЛ, но уровень сознания пациентки снизился до сопора 10 баллов по ШКГ, также пациентка была гемодинамически не стабильна, были подключены вазопрессоры. Все это служит противопоказанием к проведению НИВЛ.
В течение недели больной проводилось ИВЛ, с тенденцией к снижению респираторной поддержки до СРАР РS, с заданными параметрами вентиляции I:Е=1:2, РЕЕР 5см H2O, PS-5 см H2O,Fi О2-30%, при этом ДО-550 – 600 мл, PIP-14-16см H2O,Pcр – 10см H2O, SрО293-94%, ЧД 16-18 в мин.OI 367ммHg. рО2 110 ммHg. рСО245мм Пациентке проводили инфузионную, антикоагулянтную, терапию, корригировали гипергликемию инсулинами (Инсулин человеческий рекомбинантный 18-24 ЕД/сут в зависимости от уровня гликемии). Применяли ферментные препараты (креон 10000 Ед во время еды), антибиотики (ванкомицин per os 1 гр утро и веч, имипенем 1 гр утро и вечер в/в кап). Состояние больной с положительной динамикой клинически и рентгенологически (Рис. 1б), стало возможным проведение деканюляциии перевод на самостоятельное дыхание. Пациентка была отсоединена от аппарата ИВЛ, проводилась инсуффляция О24-6л вмин. Однако попытка перевода на самостоятельное дыхание была безуспешной, что выражалось в гипоксимиии рО 290 мм, нарастала гиперкапния 55ммHg,снижалась SрО288%. Указанные клинические трудности затрудняли перевод на самостоятельное дыхание и в тоже время повышали известные риски развития осложнений от продленной ИВЛ и длительного нахождения трахеостомической трубки. Принятие решения согласовалось с данными о удовлетворительной переносимости дыхательного шлема и снижении рисков, связанных с эндотрахеальной интубацией и с применением лицевой маски.
При попытке проведения масочной НИВЛ стандартным оборудованием, ввиду негерметичности дыхательного контура и развивавшейся значительной утечки кислородно – воздушной смеси, через открытую трахеостому – было клинически бесперспективно. Кроме того известны различные осложнения возникающие при применении стандартных масок для НИВЛ. Наиболее частыми из них являются некрозы кожи лица, конъюнктивиты, раздражение кожи носовой области, транзиторная гипоксемия, общий дискомфорт, аэрофагия. Эрозии и некрозы кожи образуются чаще всего в месте наибольшего давления маски на кожу лица (обычно мостик носа). Транзиторная гипоксемия появляется во время перерыва между сеансами НИВЛ, когда пациент снимает маску.
Вследствие описанных выше сложностей было принято решение о деканюляции и продолжении НИВЛ через шлем StarMedCaStarR (Intersurgical), который обеспечивает герметичность дыхательного контура без сдавливания кожных покровов, в том числе при изменении положения головы и тела пациента (рис. 2a). Принятие решения согласовалось с данными об удовлетворительной переносимости дыхательного шлема и снижении рисков, связанных с эндотрахеальной интубацией и с применением лицевой маски.
НИВЛ проводиласьреспиратором «Engstrоng» в режиме вентиляции CPAP, с параметрами: РЕЕР5 см H2O, FiО2-30%, Psupp14см H2O, время нарастания 150мсек. Остаточный поток 50%. Триггер3 л/мин. При этом ЧД 16-18 в мин, Sat О2- 94-96%. OI 373 ммHg. рО2 112 ммHg. рСО246мм.
Рис. 2 a. Больная К. во время лечения. Примечание: применение шлема (helmet) для НИВЛ StarMedCaStarR(Intersurgical).
Прозрачный и легкий шлем можно использовать в положении полусидя и лежа на спине, что создает удобство для активизации пациента. Он состоит из прозрачного пластикового цилиндра, который полностью покрывает голову больного и плотно фиксирует вокруг шеи при помощи подмышечных креплений. Преимуществами шлема являются: возможность обеспечения герметичного крепления неинвазивного интерфейса больным с практически любым контуром лица, отсутствие повреждений кожи и больший комфорт для пациента. Наличие порта доступа к пациенту позволяет производить сестринские и врачебные манипуляции не снимая шлема, кормить и поить пациента.
После налаживания интерфейса, который закрывал своим нижним краем открытую трахеостому герметичность дыхательного контура была достигнута. К концу вторых суток НИВЛ была прекращена, больная переведена на самостоятельное дыхание, с инсуффляцией О2 4л в мин. При этом рО2 125 ммHg. рСО2 45мм. ЧДД 18-20в мин. OI 416 ммHg.
В дальнейшем пациентка переведена в нефрологическое отделение. В отделении проводилась медикаментозная терапия, круглосуточная инсуффляция О2 со скоростью 4 л в мин при этом SpO2 98% в течении трех дней. В дальнейшем инсуффляция кислорода требовалось только в ночное время, так как SpO2 снижалась до 86% во время сна. Через две недели наблюдения в профильном отделении состояние больной удовлетворительное SpO2 96% – 98% на атмосферном воздухе, отмечалось снижение веса на 25 кг в следствии успешной заместительной почечной и диуретической терапии. С учетом разрешения пневмонии, полного излечения псевдомембранозного колита, купирования всех составляющих полиорганной недостаточности и клинической стабилизации состояния, пациентка выписана домой для продолжения терапии амбулаторно вкючая CPAP-терапию.
Обсуждение: Пациенты страдающие ПС относятся к группе лиц с высоким риском неблагоприятных клинических исходов. В отечественной литературе описаны единичные клинические примеры успешного и не очень ведения пациентов с СОГ осложненного тяжелой ЛГ и ОДН, требовавшие перевода в ОРИТ и ИВЛ. Описаний успешных клинических исходов пациентов с ОПП, декомпенсацией ХСН, сепсисом, ОДН на настоящий момент нами не обнаружено. Зарубежными авторами рекомендуется применение НИВЛ и набирает популярность использование экстракорпоральной мембранной оксигеннации (ЭКМО) в подобных клинических ситуациях. Ввиду наличия значимого риска развития осложнений; таких как: кровотечение из канюли, внутричерепное кровоизлияние инфицирование канюли свертываемость оксигенатора, тромбоз, а также гепарин-индуцированную тромбоцитопению, было принято решение в пользу ИВЛ с последующим НИВЛ. Представленное наблюдение одно из первых демонстрирует успех мультидисциплинарного подхода в лечении коморбидной пациентки страдающей СОГ и сахарным диабетом с развившимися псевдомембранозным колитом и госпитальной пневмонией осложненными сепсисом, ОПП, ОДН, декомпенсацией ХСН. Полагаем, что одним из значимых слагаемые клинического успеха являлось НИВЛ с использованием шлема StarMedCaStarR.
Выводы: Приведенное наблюдение свидетельствует об успешном применении шлема StarMedCaStarR у пациентки с СОГ и открытой трахеостомой в первые сутки после деканюляции и дает основание для его дальнейшего широкого использования в клинической практике у данной когорты пациентов.
Литература:
- Любченко П.Н., Атаманчук А.А. Оценка общих и профессиональных рисков развития гипертонической болезни у рабочих машиностроительных заводов, контактирующих с вредными производственными факторами. Альманах клинической медицины. 2012; 27: 72-76.
- Атаманчук А.А., Дмитрук Л.И. Оценка риска наличия синдрома сонного апноэ среди водителей пассажирского автотранспорта в московской области. Медицина труда и промышленная экология. 2017; 9: 10-11.
- Муромцева Г. А., Концевая А. В., Константинов В. В., Артамонова Г. В., Дупляков Д. В., Ефанов А. Ю. Распространенность факторов риска неинфекционных заболеваний в российской популяции в 2012 – 2013 гг. Результаты исследования ЭССЕ-РФ.Кардиоваскулярная терапия и профилактика. 2014; 13(6): 4 – 11.
- Ачкасов Е.Е., Рапопорт С.И., Руненко С.Д., Разина А.О. Ожирение: современный взгляд на проблему. Клиническая медицина. 2016; 94 (5): 333 – 338.
- Качурина К.В., Дорожкина Н.С., Сухарев В.А. Ожирение – как один из предрасполагающих факторов развития синдрома пиквика. разбор клинического случая. Смоленский медицинский альманах. 2017; 1:112-115.
- Насыбуллина Р.С., Рубанова Э.Ф., Сайфутдинов Р.Р., Багрянова И.Д., ГваршивилиН.А., Сайфутдинов Р.Г. Клинический случай Пиквикского синдрома. Дневник казанской медицинской школы. 2013; 3(3): 57-62
- BurwellC.S., RobinE.D., WhaleyR.D., Bickelmann A.G.Extreme obesity associated withalveolar hypoventilation:
A Pickwickian syndrome. Am. J. Med .1956; 21: 811-818. - Biring M.S., Lewis M.I., Liu J.T., Mohsenifar Z. Pulmonary physiologic changes of morbid obesity. Am.J.Med.Sci. 1999;318:293-7
- Chlif M., Keochkerian D., Mourlhon C., Choquet D. Ahmaidi S. Noninvasive assessment of the tension-time index of inspiratory muscles at rest in obese male subjects. Int.J.Obes.(Lond) 2005;.29:1478-83.
- Недогода С.В., Барыкина И.Н., Саласюк А.С. Национальные клинические рекомендации по ожирению: концепция и перспективы. Вестник Волгоградского государственного медицинского университета. 2017; 1 (61) : 134-140.
- Скрягин А. Е. Неинвазивная вентиляция легких: учеб-метод. пособие. Минск. БГМУ. 2011.
- Брусенцев О.Ю., Кудин Н.К., Мигунов С.А., Семенькова Г.В. Опыт использования шлема для неинвазивной вентиляции STARMED CASTAR R у пациента с морбидным ожирением. Здравохранение Югры: опыт и инновации. 2018;3:29-33.
- Неинвазивнаявентиляция легких : учеб.-метод. пособие / А. Е. Скрягин [и др.]. – Минск : БГМУ, 2011. – 27 с
- Интенсивная терапия при обострениях хронической обструктивной болезни легких / С. В. Царенко, О. Р. Добрушина – Москва : Медицина :Шико, 2008. – 105, [1] с. : ил.; 14 см. – (Практическая реаниматология; вып. 2).
- Wijdicks EF et al. Validation of a new coma scale: The FOUR score. Ann Neurol. 2005 Oct;58(4):585-93.
- Пермякова Н.В., Долгова О.Б., Соколова С.Л., Кобелев Ю.Г. СЛУЧАЙ СМЕРТИ ПРИ СИНДРОМЕ ПИКВИКА В СУДЕБНО-МЕДИЦИНCКОЙ ПРАКТИКЕ Евразийский союз ученых. 2015. № 2-4 (11). С. 139-142.
- Шкляев А.Е., Семеновых Е.А., Денисова Н.Ю.ВОЗМОЖНОСТИ ЛЕЧЕНИЯ ДЕКОМПЕНСАЦИИ ХРОНИЧЕСКОЙ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ НА ФОНЕ МОРБИДНОГО ОЖИРЕНИЯ (КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ) Дневник казанской медицинской школы. 2018. № 4 (22). С. 135-139.
- Warricker F, Islam Z, Shah BN. Lesson of the month 1: Obesity hypoventilation (Pickwickian) syndrome: a reversible cause of severe pulmonary hypertension. Clin Med (Lond). 2017 Dec;17(6):578-581. doi: 10.7861/clinmedicine.17-6-578.
- Lederer H, Stalder M, Tisljar K, Lanzi F, Landmann E, Mosimann T, Zeeh F, Zuercher S, Mosimann V, Spiegel R, Sutter R, Hunziker P. Venovenous extracorporeal membrane oxygenation to treat hypercapnia in a morbidly obese patient. Swiss Med Wkly. 2018 Jul 12;148:w14639. doi: 10.4414/smw.2018.14639. eCollection 2018.
Примечания:
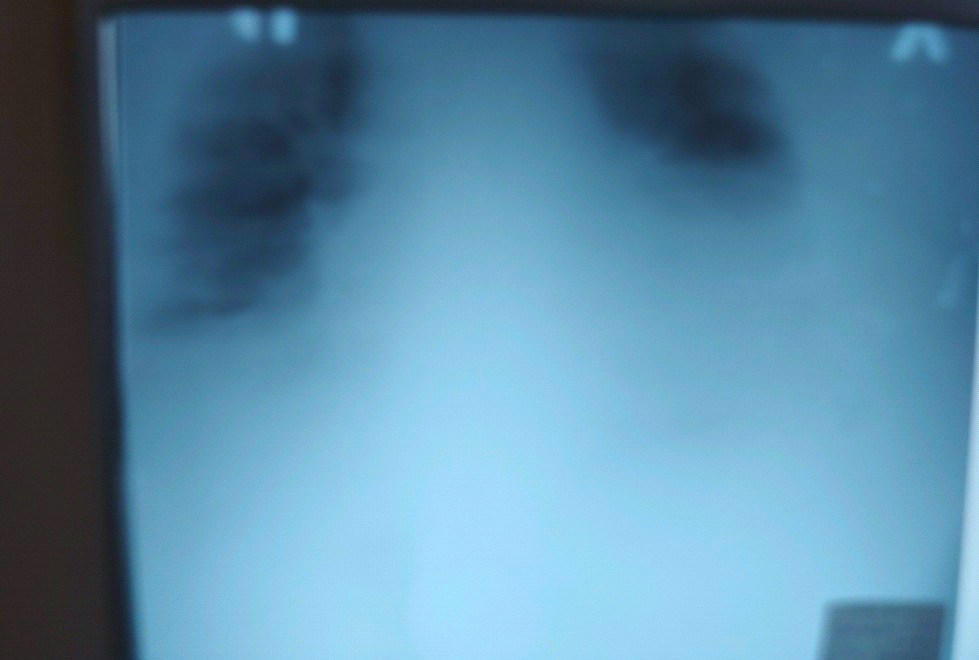
1а снимок
В легких определяется венозное полнокровие, эмфизема с обеих сторон. Гомогенное затемнение легочных полей больше слева за счет наличия жидкости в плевральных полостях и неоднородная инфильтрация на фоне жидкости. Куполы диафрагмы не дифференцируются, срединные тени расширены.
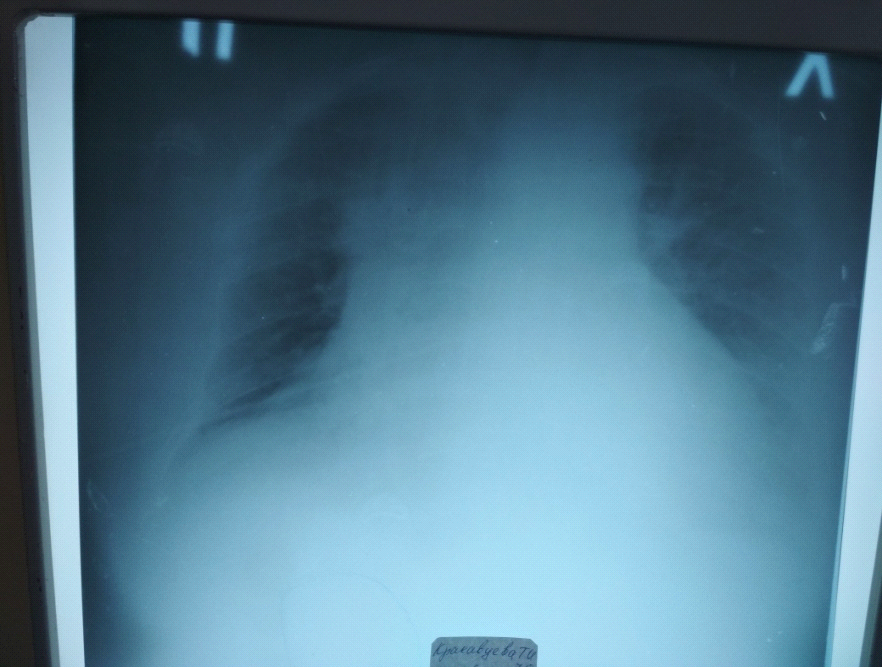
2б снимок
На Rg контроле динамика в положительную сторону количество жидкости в плевральных полостях уменьшилось справа дифференцируется купол диафрагмы. Прозрачность легочных полей стала больше за счет рассасывания инфильтрации.
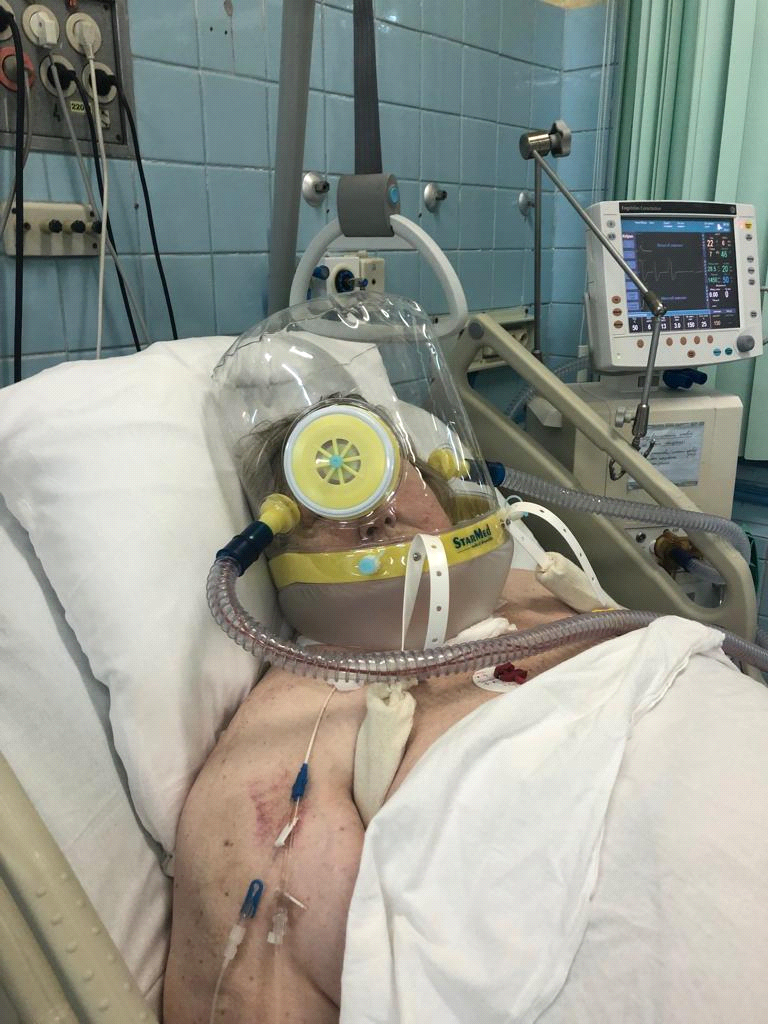
Рис. 1 . Больная К. во время лечения.
Примечание: a– применение шлема (helmet) для НИВЛ StarMedCaStarR(Intersurgical).
Прозрачный и легкий шлем можно использовать в положении полусидя и лежа на спине, что создает удобство для активизации пациента. Он состоит из прозрачного пластикового цилиндра, который полностью покрывает голову больного и плотно фиксирует вокруг шеи при помощи подмышечных креплений. Преимуществами шлема являются: возможность обеспечения герметичного крепления неинвазивного интерфейса больным с практически любым контуром лица, отсутствие повреждений кожи и больший комфорт для пациента. Наличие порта доступа к пациенту позволяет производить сестринские и врачебные манипуляции не снимая шлема, кормить и поить пациента.