Мазурок В. А.
Федеральное государственное бюджетное учреждение «Национальный медицинский исследовательский центр имени В. А. Алмазова» Министерства здравоохранения Российской Федерации, Санкт-Петербург, Россия
Контактная информация:
Мазурок Вадим Альбертович,
ФГБУ «НМИЦ им. В. А. Алмазова»
Минздрава России,
ул. Аккуратова, д. 2, Санкт-Петербург,
Россия, 197341.
E-mail: vmazurok@mail.ru
Статья поступила в редакцию 16.12.2020 и принята к печати 25.01.2021.
Резюме
Интенсивная терапия внебольничных пневмоний в условиях массового поступления пациентов в течение 2020 года преподнесла немало уроков, в том числе касающихся стратегии проведения респираторной поддержки, так как оказалось, что искусственная вентиляция легких (ИВЛ) у пациентов с COVID-19 практически равносильна смертельному приговору. С другой стороны, сохранение самостоятельного дыхания в условиях диспноэ и гиперпноэ может вызывать специфическое самоповреждение легких.
Неожиданно хорошая переносимость пациентами гипоксемии стала причиной появления терминов «счастливая гипоксия» и «пермиссивная гипоксемия», отражающих эффективное функционирование острых адаптационных механизмов: повышение производительности сердца и утилизации кислорода.
Сформировалась пошаговая стратегия проведения респираторной терапии: 1) кислородотерапия (низкопоточная, высопоточная); 2) неинвазивная респираторная поддержка (НИВЛ); 3) управляемая вентиляция легких. Положение на животе продемонстрировало высокую эффективность мобилизации альвеол у пациентов с COVID-19.
По сравнению с тугой маской, шлем доказал преимущества при осуществлении НИВЛ. При использовании шлема не развиваются пролежни на лице и переносице, возможно проведение энтерального питания, повышается субъективная переносимость НИВЛ.
Перевод на инвазивную ИВЛ рассматривается в случае энергетической неприемлемости самостоятельного дыхания и развития нарушений центральной нервной системы. Для проведения как ИВЛ, так и особенно НИВЛ необходимо дыхательное оборудование, обладающее широким набором режимов вентиляции и экспертными возможностями респираторного мониторинга.
При невозможности легочного газообмена единственным средством спасения пациента остается проведение экстракорпоральной мембранной оксигенации — метода, требующего огромных энергетических затрат со стороны подготовленного медицинского персонала и хорошей технической оснащенности клиники.
Одним из самых наглядных уроков, преподнесенных пандемией вирусных пневмоний, стала безуспешная попытка ускоренной подготовки «реаниматологов» посредством онлайн-курсов, вебинаров и даже листков-путеводителей.
Ключевые слова: механическая респираторная поддержка, счастливая гипоксия, шлем, COVID-19.
Для цитирования: Мазурок В.А. Механическая респираторная поддержка при COVID-19: уроки 2020 года. Трансляционная медицина. 2021; 8 (1): 19-37. DOI: 10.18705/2311-4495-2020-8-1-19-37
Список сокращений:
АТФ — аденозинтрифосфат, ИВЛ — искусственная вентиляция легких, МОД— минутный объем дыхания, НИВЛ— неинвазивная вентиляция легких, ОРИТ — отделение реанимации и интенсивной терапии, РДСВ — респираторный дистресс-синдром, ЭКМО — экстракорпоральная мембранная оксигенация
Введение:
Интенсивная терапия внебольничных пневмоний в условиях массового поступления пациентов в течение 2020 года преподнесла профессиональному медицинскому сообществу анестезиологов-реаниматологов немало уроков. Острейший дефицит дыхательного оборудования во всем мире стал причиной ускоренной разработки многочисленных версий аппаратов искусственной вентиляции легких (ИВЛ), в том числе на основе двигателей, совершенно не предназначенных для таких целей: от автомобилей (контракты с General Motors, Ford, Mercedes и др.), пылесосов, стеклоочистителей и т. п. Правительства государств стали направлять значительные ресурсы на оснащение клиник дыхательным оборудованием. США потратили 2,9 млрд долларов на приобретение 190.000 аппаратов ИВЛ, а ее президент (D. Trump) провозгласил государство королем вентиляторов («The King of Ventilators»). На этом фоне на рынке дыхательного оборудования стали появляться приборы, которые, в силу их конструктивных особенностей, невозможно назвать респираторами стационара (рис. 1, 2). Среди членов Комитета по респираторной и метаболической поддержке Федерации анестезиологов и реаниматологов (ФАР) России весной 2020 года разгорелась дискуссия относительно позиции профессионального сообщества о возможности использования таких аппаратов в отделениях реанимации и интенсивной терапии (ОРИТ). Точку в этих дебатах поставил безвременно ушедший от SARS-CoV-2 профессор Николаенко Эдуард Михайлович, написав: «При наличии в ОРИТ таких аппаратов администрацией они будут причислены к имеющимся вентиляторам, которых, как мы знаем из сообщений СМИ, в нашей стране больше, чем в какой-либо другой». Следует отметить, что с этой проблемой столкнулись врачи во многих странах мира. Жалобы коллег из Испании на оказавшиеся никуда не годными аппараты ИВЛ, второпях выпущенные и предназначенные для амбулаторных условий, а не для ОРИТ, стали достоянием общественности. Правительство Великобритании аннулировало заказ тысяч таких образцов дыхательной техники, т.к. для работы необходимы более сложные аппараты. Трагическая гибель пациентов в клиниках Москвы и Санкт-Петербурга в результате возгораний респираторов «Авента-М» в мае 2020 года пополнила список связанных с нехваткой дыхательной аппаратуры проблем.
Отчаянной попыткой как-то выйти из создавшегося положения стала пришедшая из-за рубежа и, к сожалению, подхваченная в России на высоком уровне, идея использования одного респиратора одновременно у нескольких пациентов (рис. 3, 4). Такое предложение оказалось настолько вопиюще непрофессиональным, что повлекло немедленную реакцию профессиональных сообществ анестезиологов США и России.

Рис. 1. Простейший аппарат ИВЛ, работающий на принципе объемного вытеснения газа из мешка
Рис. 2. Простейшее одноразовое устройство для искусственной вентиляции легких, генерирующее циклические изменения давления газа
Рис. 3. Пропагандирование идеи использования одного респиратора одновременно у нескольких пациентов

Рис. 4. Подхват в России идеи использования одного респиратора одновременно у несколькихпациентов
Переосмысление приоритетов механической респираторной поддержки при COVID-19
Тревожные данные относительно исходов лечения пациентов с COVID-19, требующих инвазивной вентиляции легких, стали поступать весной 2020 года со всех уголков планеты: Китая, Италии, США. Анализ 5700 пациентов клиник в районе Нью-Йорка, находившихся на ИВЛ, продемонстрировал летальность около 90 %, что вызвало большой общественный резонанс. Похожие цифры летальности были получены при анализе первых 125 инвазивно вентилируемых пациентов больницы в Коммунарке — выжило только 17 человек. Летальность у пациентов COVID-19 в Ломбардии (Италия), наиболее пострадавшем районе, в марте 2020 года составила 68 %.
Такой высокий процент неблагоприятных исходов заставил медицинское сообщество задуматься о стратегии проведения респираторной поддержки, так как привел к осознанию того, что ИВЛ у этой категории пациентов равносильна смертельному приговору. Относительно справедливости столь брутального предположения, однако, достаточно рано стали высказываться сомнения. Они были связаны, прежде всего, с клинико-возрастными характеристиками умерших и принципом констатации причин летального исхода. В частности, в Италии умершими от COVID считали всех, у кого вирус был обнаружен при жизни или после смерти вне зависимости от предшествующих заболеваний. То есть, несмотря на то, что умершие в подавляющем большинстве случаев, были людьми весьма преклонного возраста (70–89 лет) с выраженной коморбидной патологией, в том числе: ишемической болезнью сердца, фибрилляцией предсердий, гипертонической болезнью, сахарным диабетом, онкологическими заболеваниями, а каждый второй (48,6 %) имел три и более сопутствующих заболевания — по статистике они прошли в качестве умерших от COVID-19.
Среди многочисленных публикаций, посвященных вентиляции легких у пациентов с COVID-19, особого места, пожалуй, заслуживает статья под названием «По мере накопления опыта врачи передумали торопиться переводить пациентов на ИВЛ», подготовленная журналистами издательства Reuters и основанная на интервью 30 врачей из Китая, Италии, Испании, Германии и США, получивших к апрелю 2020 года опыт лечения такой категории пациентов. В частности, в ответ на вопрос «Убивает ли ИВЛ?», Thierry Fumeaux, глава ОРИТ в г. Ньон (Швейцария) и президент швейцарского общества интенсивной терапии отвечает: «Нет. Убивает заболевание легких». С ним согласен Mario Riccio, глава ОРИТ клиники The Oglio Po (район Кремоны, Ломбардия, Италия), который считает, что: «На ИВЛ погибают, но это не подрывает факта, что вентиляция — единственный метод лечения COVID-19». При этом точка зрения David Hill, пульмонолога и реаниматолога клиники в Уотербери (Коннектикут, США), который на вопрос о длительной вентиляции легких замечает: «Это сложно, мы лечим не по протоколам», и, что не может не импонировать анестезиологам-реаниматологам, добавляет: «Это не беготня вокруг вентилятора, это бег вокруг профессионализма».
Принимая во внимание физиологические проблемы, присущие механической респираторной поддержке, включающие многочисленные травмы легких (волюмо-, баро-, ателекто-, био-, мио-, эрго-), до перевода пациента на ИВЛ необходима взвешенная оценка ее пользы/риска. В этой связи становится особенно интересен опыт немецкой пульмонологической клиники (The Bethanien Hospital lung clinic, Moers, Germany), известной нежеланием ее специалистов переводить пациентов на ИВЛ. Глава клиники пульмонолог Thomas Voshaar говорит: «Убедительно не рекомендую раннюю интубацию при COVID-19», и приводит один из клинических случаев, ставший достоянием широкой общественности.
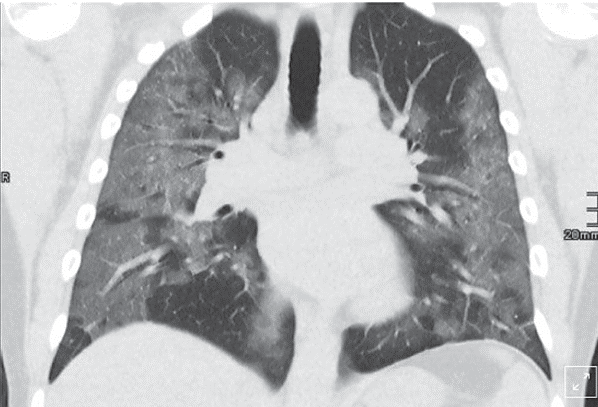
Andre Bergmann, 48 лет, врач, спортсмен-троеборец, поступил в клинику с COVID-19. Вскоре после поступления развилась острая нехватка кислорода, и, с учетом рентгенологической картины (рис. 5), ИВЛ казалась неизбежной. Однако на ИВЛ пациента не перевели, а неделю спустя выписали из больницы. Залогом такого феноменального успеха стала принятая в клинике тактика лечения больных с острой дыхательной недостаточностью: вместо ИВЛ врачи используют ингаляцию кислорода через маску и морфин.
Рис. 5. Рентгенологические изменения в легких у пациента, 48 лет (пульмонологическая клиника в Германии, The Bethanien Hospital lung clinic, Moers, Germany)
Повреждение легких в результате самостоятельного дыхания? Обоснование использования опиатной седации
Применение морфина с целью вазоплегии, купирования одышки и дыхательной паники при кардиогенном отеке легких не ново, однако введение морфина в терапии первичной дыхательной недостаточности нуждается в пояснении. Такая лечебная тактика преследует профилактику SILI (self-inflicted lung injury) — повреждения легких в результате самостоятельного дыхания, развивающегося у пациентов с COVID-19 и подразумевающего травму альвеол в результате выраженной одышки и, прежде всего, значительного усилия вдоха.
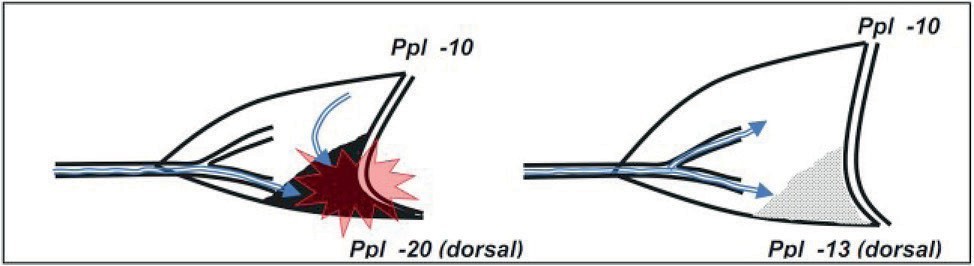
Патогенетическая цепочка «самоповреждения легких» запускается гипоксией, которая приводит к гипервентиляции и тяжелому диспноэ — одышке с высоким транспульмонарным градиентом (ΔPtp).
Чем больше разница между плевральным давлением и давлением в дыхательных путях (ΔPtp), тем больше повреждение в большей степени дорзально расположенных альвеол (рис. 6). Применение морфина преследует цель, во-первых, снизить дыхательное усилие пациента, т. е. транспульмонарный градиент, а во-вторых, потребление кислорода (VO2) за счет уменьшения работы дыхательной мускулатуры.
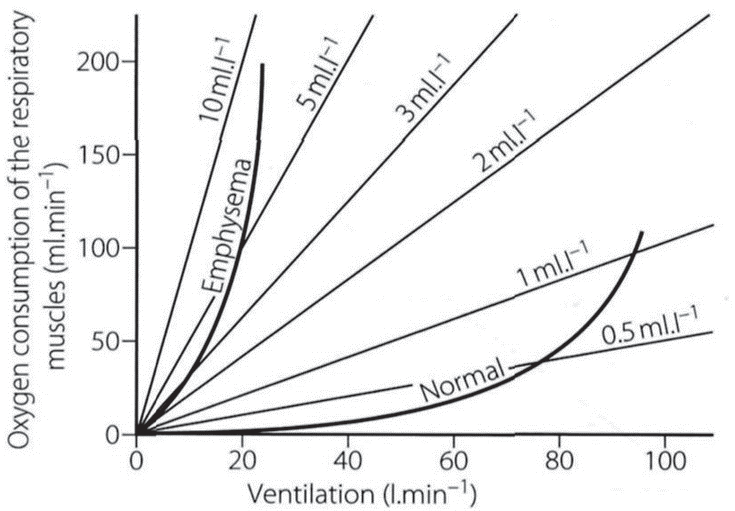
Последнее особенно важно, если принять во внимание невысокий коэффициент полезного действия работы дыхательной мускулатуры в целом. Обоснование тому было представлено еще в середине ХХ века в журнале прикладной физиологии. Согласно данным, представленным на рисунке 7, при спокойном паттерне дыхания дыхательная мускулатура потребляет лишь 0,5 мл кислорода на один литр минутного объема дыхания (МОД). В случае развития тяжелого диспноэ, например при эмфиземе легких, хронической обструктивной болезни, избыточная работа дыхательных мышц требует значительно большего количества кислорода — до 10 мл О2 на литр минутной вентиляции. Если представить себе, что при спокойном дыхании МОД составляет 5–6 л, то потребление кислорода дыхательными мышцами окажется примерно 2,5–3 мл/мин. В случае одышки и гипервентиляции МОД может достигать 15–25 л и более, тогда на обеспечение работы дыхательной мускулатуры может требоваться 150–250 мл/мин кислорода (10 мл О2 на литр МОД). Учитывая среднее VO2 человека 250 мл/мин, «цена дыхания» в такой ситуации становится непомерной.
Таким образом, контроль пациента над своим дыханием, благодаря исключению многочисленных нефизиологических эффектов искусственной вентиляции легких, являющийся, по мнению Georgopoulos D. с соавторами, «достойным легочно-защитным механизмом», имеет и оборотную стороны медали.
Справедливости ради, однако, следует отметить, что SILI — умозрительный феномен, академически строгой доказательной базы относительно реального существования которого пока не существует, а возможность повреждения легких в результате самостоятельного дыхания является теоретическим умозаключением, базирующимся на классических представлениях о биомеханике дыхания и традиционных механизмах повреждения легочной ткани.
Рис. 6. Механизм развития «самоповреждения легких» [10]: Ppl — плевральное давление, Ppl (dorsal) — плевральное давление на дорзальной стороне
Рис. 7. Потребление кислорода на один литр минутной вентиляции легких при разных паттернах самостоятельного дыхания (объяснение в тексте): Emphysema — эмфизема, Normal — нормальное состояние
Положение на животе — лучший маневр мобилизации альвеол
Опыт интенсивной терапии пациентов с вирусными внебольничными пневмониями дал дополнительные многочисленные свидетельства высокой эффективности нахождения пациентов в положении на животе. То, что поворот на живот — пронирование (prone-position, прон-позиция) — эффективная методика, применяемая с целью снижения выраженности гипоксемии, известно было и до эпидемии COVID-19. Доказательная база в пользу пронирования взрослых пациентов с респираторным дистресс-синдромом (РДСВ) стала появляться на рубеже XXI века, а уже в 2008 году метаанализ пяти крупных исследований, посвященных изучению клинических исходов у нескольких тысяч пациентов с РДСВ, находившихся либо на «традиционной» вентиляции, либо на вентиляции с периодическим (≥ 6 ч/день) поворотом на живот, продемонстрировал снижение летальности у наиболее тяжелых пациентов. Полученные результаты нашли подтверждение и в последующих исследованиях. В 2010 году в результате метаанализа 1724 пациентов с РДСВ выявлено снижение абсолютной летальности на 10 % в подгруппе пациентов с наиболее тяжелой гипоксемией (индекс PaO2/FaO2 < 100), находившихся на вентиляции с периодическим поворотом на живот. В пользу пронирования выступил и L. Gattinoni — один из мировых лидеров в области респираторной поддержки.
Опыт лечения пациентов с COVID-19 укрепил позитивное отношение профессиональной общественности к проведению вентиляции в положении на животе. Глава ОРИТ Университетского медицинского центра в Стоуни-Брук (Лонг-Айленд, Нью-Йорк, США) Scott Weingart отмечает, что «изменения положения тела оказывают впечатляющее влияние на оксигенацию» и, напротив, «если оставить пациента в одной позиции — быстро развивается десатурация». Улучшение системной оксигенации при поворотах тела обусловлено перераспределением жидкости из заднебазальных отделов легких и повышением их воздушности, и, таким образом, улучшением вентиляционно-перфузионных отношений (рис. 8).
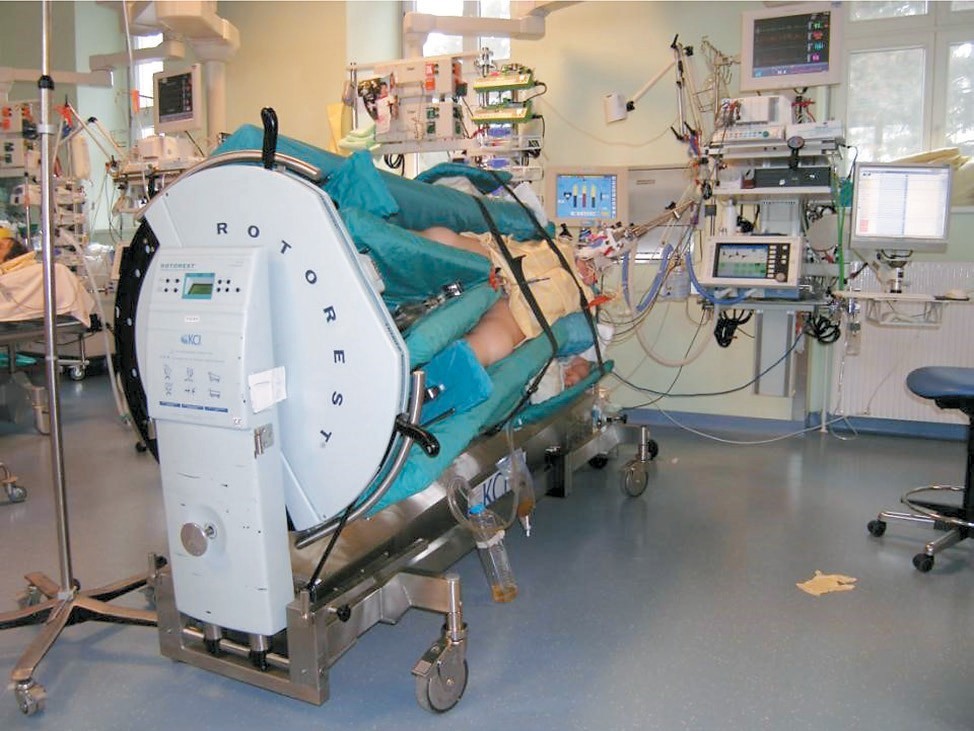
При очевидных преимуществах мобилизации альвеол посредством периодического пронирования поворот пациента на живот нередко связан с серьезными трудностями и осложнениями. Вентиляция на животе может вызывать пролежни на лице и носу, приводить к проблемам с дыхательными путями — миграции эндотрахельной или трахеостомической трубки, обтурации ее просвета и т. п., что требует внимательного отношения как собственно к процедуре поворота, так и укладке пациента, использованию дополнительных подушек и валиков. За время перепрофилирования НМИЦ им. В. А. Алмазова в инфекционный стационар практически все пациенты с COVID-19 как в инфекционных отделениях, так и в ОРИТ значимую долю времени находились в положении на животе (рис. 9). Следует отметить, что существует элегантное (хотя и очень дорогостоящее) техническое решение многочисленных трудностей, связанных с поворотом критического пациента на живот. Использование специальной вращающейся кровати (рис. 10), способной в постоянном режиме изменять боковой наклон до 62° в каждую сторону, существенно облегчает повороты и снижает связанные с ним риски.
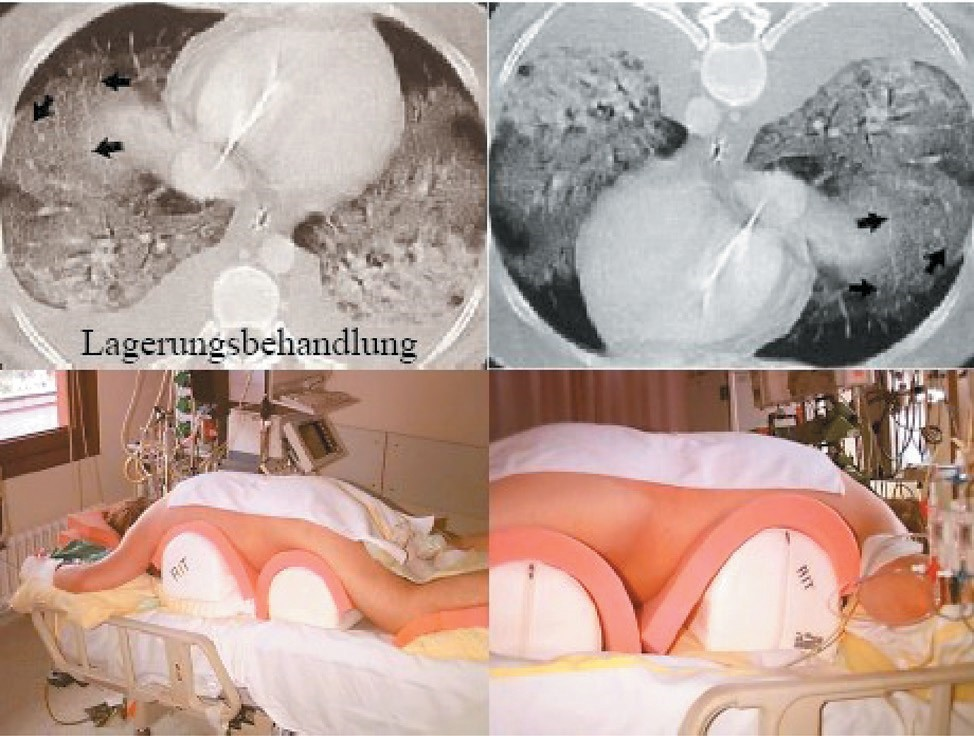
Рис. 8. Перераспределение жидкости из дорзальных отделов легких и повышение их воздушности в результате пронирования пациента
Рис. 9. Пациент на ИВЛ через трахеостомическую канюлю в положении на животе (собственное наблюдение)
Рис. 10. Вращающаяся кровать, в автоматическом режиме изменяющая боковой наклон до 62° в каждую сторону (Университетская клиника, г. Вена)
Пермиссивная гипоксия — новая сущность?
Мировой опыт работы с пациентами COVID-19 обогатил наши клинико-физиологические представления несколькими весьма существенными деталями. Одна их них — способность переносить больными даже тяжелую гипоксемию практически без клинической картины, что послужило появлению термина «допустимая гипоксемия» (по аналогии с пермиссивной гиперкапнией). Суть явления состояла в том, что традиционные лабораторные критерии недостаточности кислородного потока и тканевой гипоперфузии — венозная десатурация, значительная артериовенозная разница по парциальному давлению углекислого газа (ΔPa-vCO2) — не сопровождались ростом лактата и субъективно достаточно спокойно переносились пациентами.
К слову, «новизна» этого феномена оказалась весьма относительной. В июне 2020 года в своей традиционно блистательной редакционной колонке профессор Martin J. Tobin пишет: «Когда-то я участвовал в эксперименте о влиянии гипоксемии на характер дыхания. Мой пульсоксиметр показывал 80% в течение часа, и я не чувствовал различий между 80 и 90 % (и выше)». И добавляет: «Мышление “по протоколу” особенно опасно при ведении пациентов с коронавирусом». В контексте обсуждения вопроса о показаниях к переводу на вентиляцию легких Martin J. Tobin акцентирует внимание на том, что для правильной оценки одышки и клинической переносимости гипоксемии «обязательно задавать открытые вопросы: “Как вы себя чувствуете? Расскажите”. И, напротив, вопросы, предполагающие ответ «да» или «нет», могут искажать реальность: «Вопрос “Вы испытываете дискомфорт при дыхании?” не рекомендован».
Неожиданно хорошая переносимость пациентами гипоксемии стала причиной появления еще одного, прямо скажем, не слишком удачного термина «счастливая гипоксия». Уже упомянутый выше Scott Weingart отмечает: «Пациенты могут разговаривать и смеяться без признаков энцефалопатии, несмотря на критически низкий уровень кислорода». Автор этой главы был неоднократным свидетелем тяжелой гипоксии у пациентов с COVID-19, находящихся в ясном сознании на самостоятельном дыхании. Жалобы такие пациенты зачастую действительно не предъявляли, однако назвать их счастливыми в этот момент едва ли было возможно. Если не становиться не метафизические позиции, то хорошую переносимость гипоксемии следует обосновать с точки зрения классической физиологии. Для этого необходимо вспомнить о зависимости между доставкой кислорода (DO2) и его потреблением (VO2) (рис. 11), а также механизмах поддержания нормального VO2 в условиях ограниченного кислородного потока.
DO2 = CВ × CaO2 = CВ × Hb × 1,39 × SаO2 + 0,0031 × PаO2, где СВ — сердечный выброс (л/мин); CaO2 — содержание кислорода в артериальной крови (мл); Hb — концентрация гемоглобина (г/л); 1,39 — число Хюфнера, означающее количество мл О2, которое может связать каждый грамм гемоглобина (от 1,34 до 1,39 мл, если гемоглобин химически чистый); SаO2 — насыщение гемоглобина кислородом в артериальной крови (%); 0,0031 — количество физически растворенного кислорода в 100 мл крови на каждый мм рт. ст. PаO2; PаO2 — парциальное давление кислорода в артериальной крови. С учетом того, что доля физически растворенного кислорода в крови ничтожна (100 мл артериальной крови при PaO2 100 мм рт. ст. содержит лишь 0,31 мл O2), его вкладом в системную доставку можно пренебречь. В этом случае представленная выше формула упрощается и приобретает следующий вид: DO2 = CВ × CaO2 = CВ × Hb × 1,39 × SаO2.
Из формулы становятся очевидными механизмы поддержания кислородной доставки в условиях гипоксемии — это увеличение сердечного выброса и концентрации гемоглобина в крови. Причем острой адаптогенной реакцией является рост производительности сердца: частоты сердечных сокращений и ударного объема.
Еще одним острым адаптационным механизмом, препятствующим развитию тканевой гипоксемии, является повышение экстракции (утилизации) кислорода. Формула утилизации кислорода имеет следующий вид: КУO2 = VO2 / DO2 × 100, где КУO2 — коэффициент утилизации кислорода.
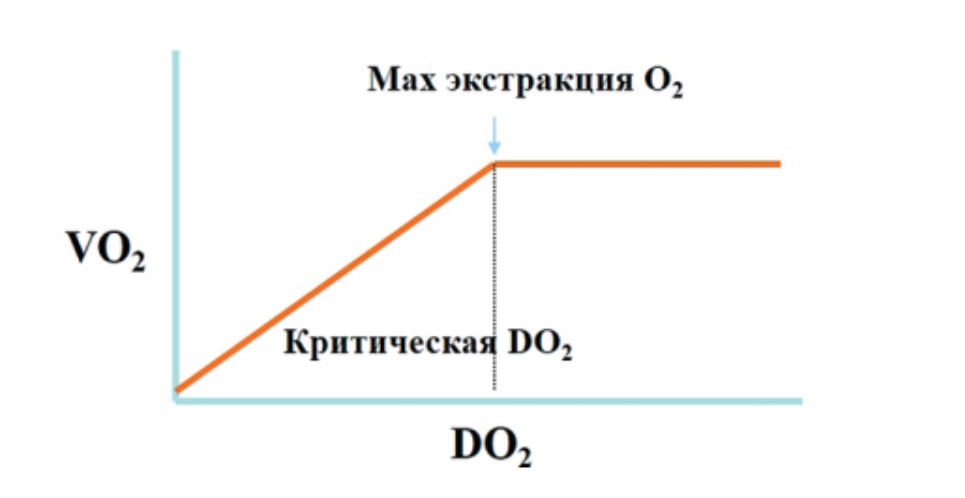
Рис. 11. Классические представления о зависимости между доставкой кислорода (DO2) и его потреблением (VO2) (объяснение в тексте)
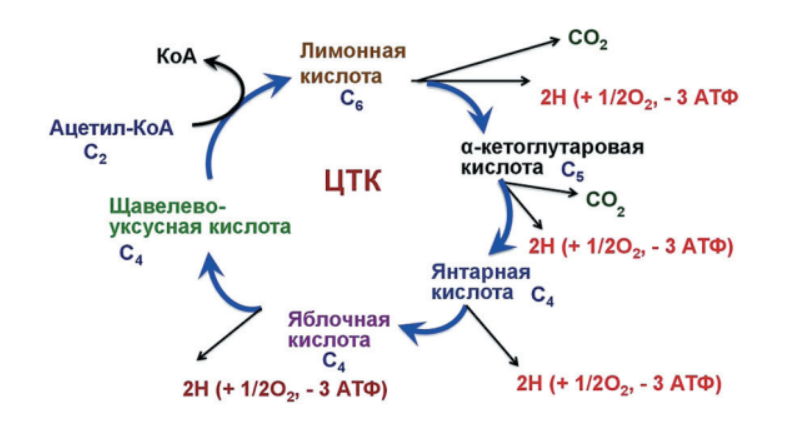
Рис. 12. Схема цикла Кребса
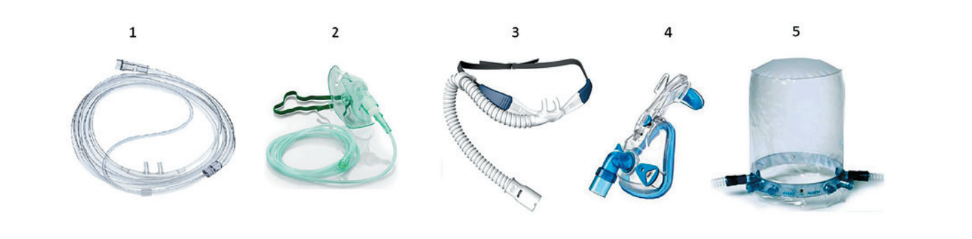
Рис. 13. Устройства для проведения кислородотерапии и неинвазивной вентиляции легких
Из курса нормальной физиологии мы помним, что DO2 составляет в среднем 1000 мл/мин, тогда как VO2 — 250 мл/мин, таким образом, нормальный КУO2 находится в пределах 25–30 %. Клеточное митохондриальное дыхание, осуществляемое циклом трикарбоновых кислот (циклом Кребса, рис. 12), предположенным биохимиком Гансом Кребсом в 1937 году, весьма эффективный механизм превращения глюкозы в аденозинтрифосфат (АТФ). Утилизация кислорода может меняться в широких пределах в зависимости от метаболической активности ткани. Меньше всего кислорода в состоянии покоя потребляют селезенка и почки, а больше всего — ЦНС, миокард и скелетные мышцы; причем КУO2 в миокарде даже в «покое» составляет 70 %, а при интенсивной физической работе может достигать 90 %.
Потребление кислорода тканями измеряется не только в процентах от доставки, но и в мл/ мин на 100 г массы органа. Профессор Richard E. Klabunde приводит следующие цифры потребления кислорода органами в зависимости от их метаболического состояния (табл. 1).

Приведенные в таблице 1 цифры показывают, что VO2 миокарда имеет весьма широкий диапазон, который зависит от состояния его механической активности. VO2 остановленным сердцем отражает базальную утилизацию АТФ, главным образом, мембранными транспортными системами. Увеличение VO2 выше базального уровня необходимо для обеспечения сокращения и релаксации миоцитов. При повышенной потребности в кислороде (во время физических упражнений) сердцу необходимо дополнительно извлекать кислород из крови коронарного русла. Аналогичная ситуация наблюдается и в отношении скелетной мускулатуры. Таким образом, как «пермиссивная гипоксия», так и «счастливая гипоксемия» — лишь свидетельства функционирующих механизмов компенсации кислородной доставки и его потребления в условиях сниженного абсолютного содержания кислорода в крови.
За одним исключением — 22 января 2021 года был опубликован препринт сообщения бельгийских авторов «SARS-CoV-2 in carotid body», где на электронной микроскопии каротидных телец были выявлены вирусы SARS-CoV-2. Таким образом, «счастливую гипоксемию» правильнее назвать «молчаливой гипоксемией», развивающейся в результате нарушения чувствительности периферических хеморецепторов к уровню парциального давления кислорода в крови.
Респираторная поддержка: все — кроме ИВЛ
Как клинический контекст, так и чрезвычайные организационные проблемы, в том числе острый дефицит сил и средств систем здравоохранения, связанный с лавинообразным поступлением пациентов с внебольничными пневмониями по всему миру, заставили пересмотреть стратегию респираторной поддержки в целом и показания к переводу больных на инвазивную вспомогательную или управляемую вентиляцию легких в частности. Немаловажный вклад в переосмысление приоритетов внесла и чрезвычайно высокая летальность пациентов с COVID-19, находившихся на ИВЛ, о чем было сказано ранее. В итоге, несмотря на бытовавшие в первые месяцы эпидемии опасения аэрозольного распространения вируса, акценты респираторной поддержки сместились на более широкое использование методов кислородотерапии и неинвазивной вентиляции легких (НИВЛ). Более того, предотвращение ИВЛ всеми возможным средствами стало практически лечебной парадигмой у пациентов с COVID-19. Эскалация методов респираторной терапии в зависимости от выраженности гипоксемии и ее клинических проявлений представлена на рисунке 13.
Появление одышки и умеренной десатурации (SpO2 92–94 %) на первых этапах заболевания можно купировать низкопоточной (1–6 л/мин) ингаляцией кислорода через носовые канюли (рис. 13, 1) или традиционную маску (рис. 13, 2). В случае нетяжелого течения заболевания этих мер может оказаться достаточно. Быстрое нарастание дыхательной недостаточности (одышка >30 дыханий /мин, SpO2 <92 % при ингаляции кислорода 6 л/мин) требует консультации реаниматолога и решения вопроса о переводе пациента в ОРИТ. Интенсивную терапию острой дыхательной недостаточности в ОРИТ следует осуществлять пошагово.
Шаг 1: предполагает продолжение ингаляции кислорода (6 л/мин) через носовые канюли или маску в положении пациента на животе с чередованием положения на боку. По возможности следует обеспечить 4 сеанса прон-позиции в сутки, по 4 часа каждый. Целью и первого, и последующих шагов следует считать удержание: 1) SpO2 >92 %, 2) РаO2 ≥ 60 мм рт. ст., 3) РаСO2 ≤ 50 мм рт. ст., 4) одышки с ЧДД < 25/мин. При невозможности обеспечить такой результат необходимо переходить к следующему шагу.
Шаг 2а: предполагает применение высокопоточной оксигенации (рис. 13, 3) с начальными параметрами: 1) FiO2 60 %, 2) скоростью потока 40 л/мин, и 3) их увеличением до максимальных (FiO2 90 %, скорость потока 60 л/мин) при необходимости. В случае невозможности удержать целевые клинико-лабораторные показатели, представленные в первом шаге, следует перейти на следующий уровень.
Шаг 2б: означает начало неинвазивной вентиляции легких через специальную тугую маску (рис. 13, 4) или шлем (рис. 13, 5). Причем шлем предпочтителен из-за значительно лучшей его переносимости пациентами.
В НМИЦ им. В. А. Алмазова НИВЛ использовалась как в инфекционных отделениях (с помощью аппаратов для лечения сонного апноэ), так и в ОРИТ на профессиональном дыхательном оборудовании. В среднем по ОРИТ на НИВЛ находились 15,4 % пациентов, остальные — на высокопоточной оксигенации, либо на инвазивной ИВЛ. На рисунках 14–17 представлены собственные наблюдения неинвазивной вентиляции легких, осуществлявшейся как при функционировании Центра Алмазова в штатном режиме, так и во время перепрофилирования на лечение пациентов с COVID-19.
Основная сложность проведения НИВЛ через маску связана с плохой ее переносимостью пациентами: чувство дискомфорта и боли в области переносицы не позволяют проводить длительные сеансы (несколько часов) вентиляции без перерывов. Особую актуальность эта проблема приобрела в условиях терапевтической антикоагуляции, предписанной пациентам с COVID-19 отечественными и зарубежными клиническими рекомендациями (рис. 14). Использование шлема в значительной степени способствует решению этой проблемы (рис. 15) и, несмотря на футуристическую и визуально достаточно громоздкую конструкцию, не мешает пациентам, с одной строны, спать в шлеме (рис. 16), а с другой — сохранять известную мобильность (рис. 17).
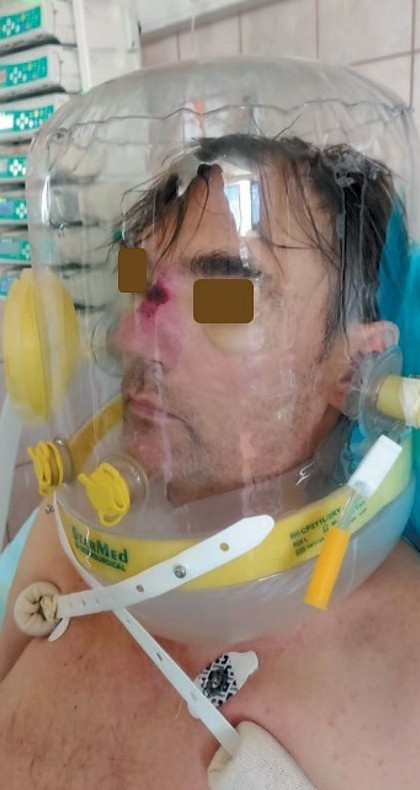
Рис. 15. Использование шлема у пациента после масочной вентиляции (виден пролежень на переносице, собственное наблюдение)
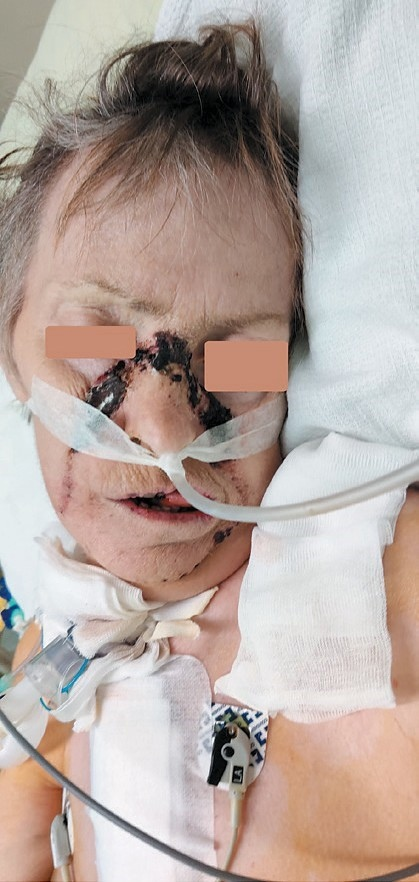
Рис. 14. Геморрагические осложнения использования масочной вентиляции на фоне системной гепаринизации пациента (собственное наблюдение)
В качестве режимов вспомогательной вентиляции можно использовать CPAP, PS, или PPV. Неинвазивную вентиляцию, как и кислородотерапию, следует пытаться осуществлять в пронпозиции или при боковом положении пациента. В случае невозможности достигнуть целевые клинико-лабораторные показатели, представленные в первом шаге, стоит подумать о седации пациента морфином для снижения: 1) выраженности диспноэ (дыхательной паники), 2) минутной вентиляции и 3) потребления кислорода. Не будет лишним напомнить, что такая тактика диктует необходимость непрерывного мониторинга оксигенации (пульсоксиметрии) и вентиляции (капнометрии). При проведении седации морфином приемлемыми считаем показатели: SpO2 ≥ 88 %, РаO2 ≥ 50 мм рт. ст., РаСO2 ≤ 60 мм рт. ст. Нарастание гипоксемии и гиперкапнии, несмотря на проведение неинвазивной вентиляции и медикаментозной седации (исключить избыточную депрессию дыхательных центров!), означает неизбежный переход к интубации трахеи и ИВЛ.
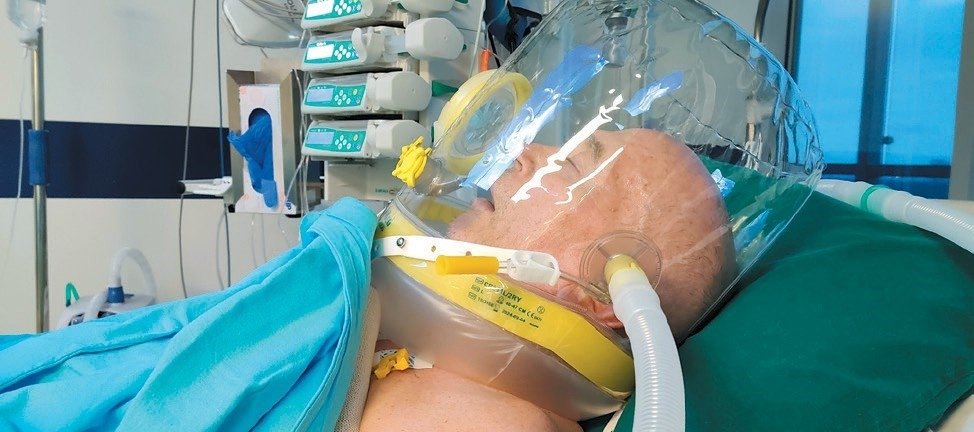
Рис. 16. В результате устранения диспноэ пациент спит в шлеме (собственное наблюдение)
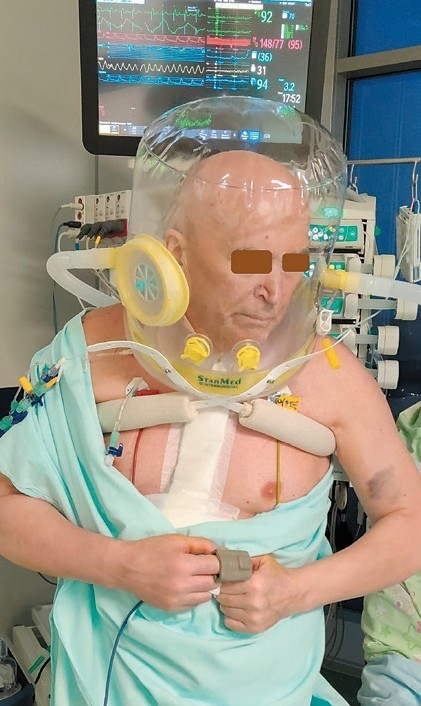
Рис. 17. Мобильность пациента при использовании неинвазивной вентиляции легких с помощью шлема (собственное наблюдение)
Показания к переводу на вентиляцию легких
На текущий момент мировые лидеры профессионального медицинского сообщества в качестве показаний к ИВЛ рассматривают не гипоксию как лабораторный феномен, но гипоксию как клинический симптомокомплекс, сохраняющийся у пациента, несмотря на кислородотерапию и методы неинвазивной респираторной поддержки. Если более конкретно, то можно вновь привести слова Scott Weingart из США: «Интубируйте пациента в сознании с гипоксией, если начинается: энцефалопатия, цитокиновый шторм, диспноэ». При том, что цитокиновый шторм для анестезиолога-реаниматолога — понятие достаточно умозрительное, то энцефалопатия и диспноэ — совершенно конкретное. Как психомоторное возбуждение на фоне нарастающей гипоксемии, так и, напротив, прогрессирующие вялость и адинамия — требуют зачастую уже инвазивной вспомогательной или управляемой вентиляции легких. О необходимости перевода пациента на ИВЛ свидетельствует и выраженное диспноэ, которое делает самостоятельное дыхание энергетически неприемлемым.
Во Временном локальном протоколе НМИЦ им. В. А. Алмазова на этапе перевода на ИВЛ оговаривается обсуждение дальнейшей тактики ведения пациента со специалистами центра экстракорпоральной мембранной оксигенации (ЭКМО) и заблаговременная оценка целесообразности и условий использования экстракорпоральной оксигенации. При этом в отдельных случаях (изолированное поражение легких, отсутствие полиорганной недостаточности и тяжелых сопутствующих заболеваний) допускается согласованное решение о проведении ЭКМО до перевода на ИВЛ.
Проведение механической вентиляции легких у пациентов с COVID-19 не имеет принципиальных отличий от таковой при респираторном дистресс-синдроме взрослых. Настройка параметров определяется наличием и паттерном самостоятельного дыхания, состоянием биомеханики аппарата внешнего дыхания [податливостью (С) контура «грудная клетка-легкие» и сопротивлением (R) воздухопроводящих путей], состоянием сердечно-сосудистой системы и волемическим статусом пациента. Подробные рекомендации по выбору режимов и настройкам аппарата ИВЛ при РДСВ представлены в клинических рекомендациях Федерации анестезиологов и реаниматологов России.
Важно отметить, что объективная интерпретация исходов лечения пациентов с COVID-19, нуждающихся в инвазивной ИВЛ, невозможна без учета показаний к ее началу, принятых в каждой конкретной клинике. Возвращаясь к апрельской публикации в JAMA, показавшей 90 % летальность у этой категории пациентов, один из ведущих специалистов в области критической медицины, профессор John W. Scott, отметил, что правильным ее названием было бы следующее: «Среди пациентов на ИВЛ летальность составила от 25 до 97 %».
У автора этой главы в апреле 2020 появился собственный опыт очно-заочного лечения пациентов с COVID-19 в разных инфекционных стационарах страны: из 12 пациентов, находившихся на ИВЛ, семерых удалось снять с искусственной вентиляции легких и перевести из ОРИТ в инфекционное отделение — таким образом, летальность составила 42 %. После перепрофилирования НМИЦ им. В. А. Алмазова на лечение этой категории пациентов такой опыт значительно расширился, однако клинические исходы оказались куда хуже: летальность у больных с COVID-19, находившихся на ИВЛ, стремилась к 100 %. Анализ выявил
причины такого расхождения: во-первых, разной возможностью к проведению кислородотерапии и неинвазивной вентиляции легких, а во-вторых, отличающимися показаниями к интубации трахеи и началу ИВЛ. Там, где следовали «классическим» показаниям, в частности, без достаточных ресурсов к высокопоточной оксигенотерапии и/или НИВЛ, интубировали пациентов при появлении лабораторной гипоксемии — результаты оказались «лучше». Более «жесткие» критерии перевода на ИВЛ приводили к «ухудшению» ее клинических исходов.
ИВЛ — когда совсем плохо
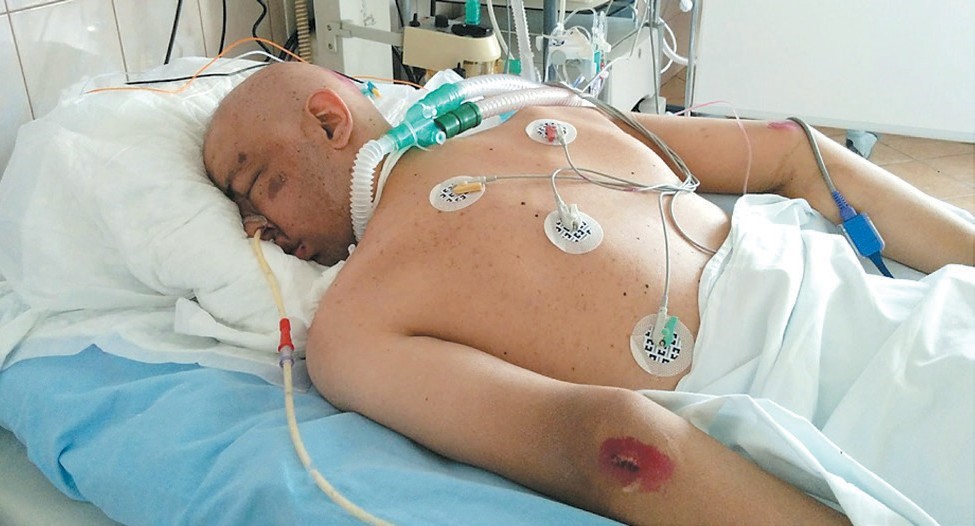
Перевод на инвазивную ИВЛ в НМИЦ им. В. А. Алмазова рассматривался практически как мера отчаяния и означал, что все методы кислородотерапии и неинвазивной вентиляции легких уже использованы и исчерпали свои возможности. В качестве примера приведем параметры биомеханики аппарата внешнего дыхания во время ИВЛ одного из пациентов, отраженные на дисплее респиратора (рис. 18): C — 3 мл/мбар и объем вдоха (VTe) — 0,097 л, несмотря на несущее давление 19 мбар (driving pressure, ∆P = Рплато – РEEP = 25 – 6 = 19). То есть дыхательный объем 97 мл — примерно вдвое меньше объема анатомического мертвого пространства — означает практическое отсутствие вклада легких в газообмен. Этим же объясняется и невысокая FiO2 40 % (рис. 18), выставленная на респираторе. Оксигенация у этого пациента поддерживалась только с помощью системы ЭКМО.
Нет необходимости убеждать профессиональную аудиторию в важности осуществления расширенного респираторного мониторинга, особенно при проведении МРП у наиболее тяжелых пациентов. Среди инструментов такого экспертного мониторинга особое место занимает неинвазивный газоанализ вдыхаемой и выдыхаемой смесей. С помощью датчиков респиратор оценивает концентрацию кислорода и углекислого газа в магистралях вдоха и выдоха.

Рис. 18. Показатели биомеханики аппарата внешнего дыхания во время ИВЛ у пациента с край- ней степенью тяжести течения COVID-19 (объяснение в тексте, собственное наблюдение)
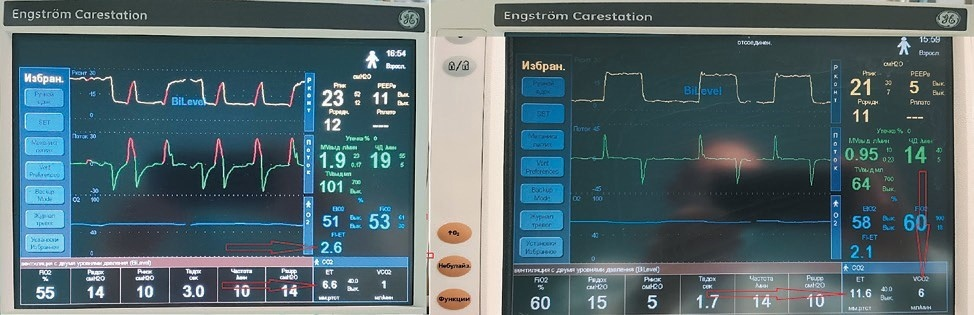
Рис. 19. Показатели неинвазивного газоанализа у крайне тяжелого пациента, находящегося на респираторе Engström Carestation (GE): малая разница Fi−Fet, низкие объемы вдоха и конечно-экспираторная концентрация углекислого газа (объяснение в тексте, собственное наблюдение)
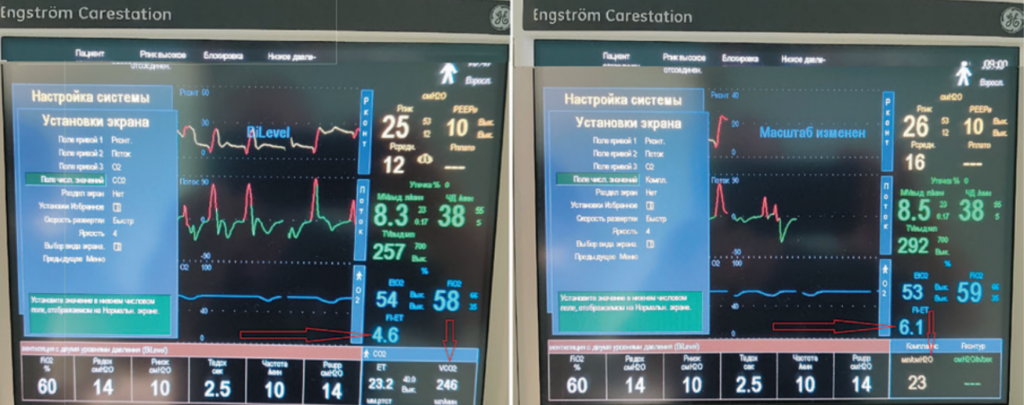
Рис. 20. Положительная динамика по показателям неинвазивного газоанализа у этого же пациента: нормальная разница Fi−Fet, увеличение дыхательного объема и конечно экспираторной концентрации углекислого газа (объяснение в тексте, собственное наблюдение)
В результате таких измерений на дисплее аппарата ИВЛ отражается, во-первых, разница в содержании кислорода на вдохе и выдохе, а во-вторых, эмиссия углекислого газа. Эти показатели являются ключевыми критериями эффективности газообмена на уровне альвеолокапиллярной мембраны. На рисунках 19, 20 представлены собственные наблюдения у пациента с крайне тяжелым течением вирусной пневмонии и грубыми нарушениями внешнего газообмена, вызванными SARS-CoV-2.
На рисунке 19 разница по концентрации кислорода на вдохе и выдохе (Fi−Fet) составляет лишь 2,1–2,6 % (стрелки), в этот момент податливость системы «грудная клетка–легкие» (комплайнс) была
5,8 мл/см Н2О. Чрезвычайно высокая жесткость легких не позволяет достичь необходимых объемов вдоха (TV) — в нашем случае от 64 до 101 мл. В итоге очень малому количеству кислорода удается попасть из альвеолярной газовой смеси в легочные капилляры из-за практически отсутствия воздушности легочной ткани (в физиологическом состоянии Fi−Fet = 4,5−6 %). Эмиссия углекислого газа в этой ситуации также чрезвычайно низка: конечно-экспираторная концентрация EtСО2 6,6– 11,6 мм рт. ст., что в абсолютных цифрах (VСО2) составляет от 1 до 6 мл/мин (стрелки).
На рисунке 20 видны позитивные изменения состояния внешнего газообмена: Fi−Fet повысилась до 4,6%, EtСО2 до 23,2 мм рт. ст., а VСО2 до 246 мл/
мин; улучшилась податливость системы «грудная клетка–легкие» — 23 мл/см Н2О (стрелки). Полный неинвазивный газоанализ — оксиметрию и капнометрию — предоставляют в настоящее время единичные образцы дыхательной техники премиального класса. В нашем случае использовался респиратор Engström Carestation (GE, General Electric), аналогичная технология представлена и в новом респираторе компании GE — CARESCAPE R860.
Наконец, от отчаяния и чувства беспомощности, порожденных невозможностью обеспечить сколько-нибудь приемлемый легочный газообмен, прибегали к использованию ЭКМО (рис.
21). К сожалению, перевод нескольких пациентов с COVID-19 на ЭКМО не увенчался успехом, в том числе потому, что по формальным критериям переводить на экстракорпоральную оксигенацию этих пациентов уже не следовало. Включение системы ЭКМО предпринималось в надежде на регресс легочных нарушений, вероятность которого при вирусной пневмонии, вызванной SARS-CoV-2, неизвестна. Таким же актом отчаяния рассматривалось и использование осцилляторной вентиляции легких (рис. 22), предпринятой на фоне работающей системы ЭКМО в попытке улучшить системную оксигенацию.
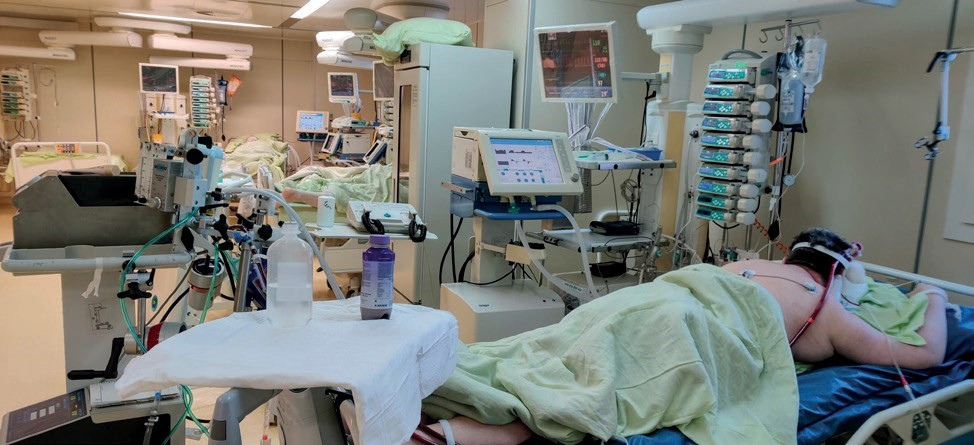
Рис. 21. Пациент с крайне тяжелым течение COVID-19, находящийся в положении на животе и экстракорпоральной мембранной оксигенации (собственное наблюдение)
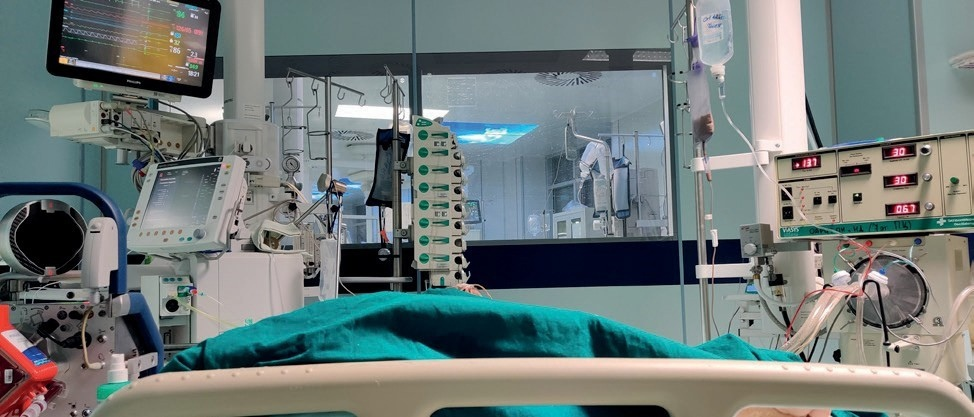
Рис. 22. Попытка использования осцилляторной вентиляции легких у пациента с крайне тяжелым течение COVID-19, находящийся на экстракорпоральной мембранной оксигенации
Клинические результаты
Анализ исходов лечения пациентов с COVID-19 в НМИЦ им. В. А. Алмазова, выполненный к.м.н. И. Ю. Кашерининовым, показал общую летальность 13,9 %, средняя летальность по ОРИТ составила 47,3 %. Анализ умерших подтвердил их клинико-антропометрические особенности, опубликованные итальянскими коллегами: преклонный возраст (в нашем случае в среднем — 71,5 лет) и многочисленная сопутствующая патология, прежде всего, со стороны сердечно-сосудистой и дыхательной систем.
Организационные аспекты
С организационной точки зрения, показателен опыт медицинской помощи в Пресвитерианской больнице Нью-Йорка (New York Presbyterian Hospital) во время пандемии COVID-19, где один реаниматолог мог курировать одновременно 96 (!) пациентов ОРИТ. Такое, однако, оказалось возможным благодаря большому количеству смежного медицинского персонала, дающему в итоге паритетное (т. е. 1:1) соотношение «медицинский сотрудник — пациент». В сформированной иерархии ключевая роль отводилась 1) владеющему ИВЛ, далее по нисходящей располагались: 2) ведущий специалист, обладающий компетенциями в интенсивной терапии (кардиолог, нефролог, терапевт, трансплантолог, хирург, кардиохирург, анестезиолог), 3) специалист 2-го уровня (терапевт, хирург, педиатр), 4) сотрудник, отвечающий за осмотр пациента при первом обращении за консультацией реаниматолога (ординаторы всех специальностей, сестры-анестезисты) и 5) специалист «плавающей потребности», выполняющий неотложные задания, в т. ч. контакт с родственниками (обучающиеся ординаторы).
В дополнение были организованы специализированные команды: 1) «Процедурная» — в чью ответственность входила катетеризация центральных сосудов в ОРИТ и других отделениях клиники (выполняли хирурги и интервенционные радиологи), 2) «Интубации» — силами анестезиологов выполнялись все интубации трахеи, 3) «Прон-команда» обеспечивала повороты пациентов (медсестры-физиотерапевты); 4) «Визуализации» — помогала при катетеризации сосудов (в т. ч. с использованием ультразвука), выполняла рентгенографию органов грудной клетки (радиологи), 5) «Гемодиализа» — проведение эфферентных методов при почечной недостаточности, 6) команда «Контакта с родственниками» брала на себя значительную работу такого рода и 7) команда «Телеконсультации» — предполагала виртуальный «обход» пациентов, находящихся на ИВЛ, два раза в день (обеспечивалась специалистами академических учреждений или ОРИТ-консультантами).
Заключение
Массовое поступление пациентов с дыхательной недостаточностью преподнесло медицинскому профессиональному сообществу несколько важных клинико-физиологических уроков, о которых речь шла выше. Однако не менее важными оказались уроки организационные и общественно-политические. В социальном плане можно без преувеличения сказать, что анестезиологов-реаниматологов теперь знают все, и традиционная «обида анестезиолога», связанная с нехваткой социального признания и нахождением в тени заслуг хирурга, материализующаяся в том числе профессиональным выгоранием, сменилась широчайшим общественным признанием специальности в целом и искусственной вентиляции легких в частности. Огорчительно, конечно, что для такой реверсии в общественном сознании понадобилась эпидемия. Как бы то ни было, забудем о «профессиональной обиде», во всяком случае на время.
Кроме значительных сил, требующихся для оказания качественной медицинской помощи, нужны соответствующие ресурсы, прежде всего, оснащение. Профессиональной дыхательной аппаратуре, в том числе премиального сегмента, имеющей возможности проведения высокопоточной кислородотерапии и НИВЛ, должна быть отведена ключевая роль. Однако без дыхательного и гемодинамического мониторинга даже самый хороший аппарат ИВЛ будет мало эффективен. В этом плане наличие всего необходимого оснащения (газоанализатор, бактериологическая лаборатория, компьютерный томограф и многое другое) должно стать не уделом ведущих клиник, а повсеместной нормой.
Наконец, пожалуй, одним из самых наглядных уроков, преподнесенных пандемией вирусных пневмоний, является безуспешная попытка ускоренной подготовки «реаниматологов» посредством онлайн-курсов, вебинаров и даже листков-путеводителей, которая, согласимся с David Hill (пульмонологом и реаниматологом клиники в Уотербери, США), является «рецептом плохого исхода».
С учетом всего вышеизложенного, проведение интенсивной терапии в целом и механической респираторной поддержки в частности является важной и высокотехнологичной составляющей медицинской помощи, необходимой пациентам с тяжелым течением COVID-19.
Конфликт интересов
Авторы заявили об отсутствии потенциального конфликта интересов.
Список литературы / References
- Aloisi S, Beasley D, Borter G, et al. Special Report: As virus advances, doctors rethink rush to ventilate. https://www.reuters.com/article/us-health-coronavirus- ventilators-specia-idUSKCN2251PE (14 December 2020).
- Аппараты ИВЛ «Авента-М» не будут использовать в больнице Петербурга до выяснения причин ЧП. https://tass.ru/proisshestviya/8451429 (14 December 2020).
- Joint Statement on Multiple Patients Per Ventilator. https://www.asahq.org/about-asa/newsroom/news-releases/2020/03/joint-statement-on-multiple-patients-per-ventilator (14 December 2020).
- ИВЛ для вентиляции двух или даже четырех пациентов. http://www.far.org.ru/newsfar/475- multipleventilation (14 December 2020).
- Richardson S, Hirsch JS, Narasimhan M, et al. Presenting characteristics, comorbidities, and outcomes among 5700 patients hospitalized with COVID-19 in the New York City Area. JAMA. 2020; 323 (20): 2052–2059. DOI: 10.1001/jama.2020.6775.
- Главврач больницы в Коммунарке: Только 17 пациентов из 125 подключенных к ИВЛ выжили. https://www.rosbalt.ru/moscow/2020/05/10/1842621.html (14 December 2020).
- Characteristics of COVID-19 Patients Dying in Italy. https://medtube.net/infectious-diseases/medical- documents/26119-characteristics-of-covid-19-patients- dying-in-italy (14 December 2020).
- Aloisi S, Beasley D, Borter G, et al. Special Report: As virus advances, doctors rethink rush to ventilate. Physician’s Weekly. https://www.physiciansweekly.com/ special-report-as-virus/ (14 December 2020).
- Yoshida T, Grieco DL, Brochard L, et al. Patient self- inflicted lung injury and positive end-expiratory pressure for safe spontaneous breathing. Curr Opin Crit Care. 2020; 26 (1): 59–65. DOI: 10.1097/MCC.0000000000000691.
- Campbell EJ, Westlake EK, Cherniak RM. Simple methods of estimating oxygen consumption and efficiency of the muscles of breathing. J Appl Physiol. 1957; 11 (2): 303–308. DOI: 10.1152/jappl.1957.11.2.303.
- Georgopoulos D, Xirouchaki N, Tzanakis N, et al. Driving pressure during assisted mechanical ventilation: Is it controlled by patient brain? Respir Physiol Neurobiol. 2016; 228: 69–75. DOI: 10.1016/j.resp.2016.03.009.
- Nakos G, Tsangaris I, Kostanti E, et al. Effect of the prone position on patients with hydrostatic pulmonary edema compared with patients with acute respiratory distress syndrome and pulmonary fibrosis. Am J Respir Crit Care Med. 2000; 161 (2 Pt 1): 360–368. DOI: 10.1164/ ajrccm.161.2.9810037.
- Piedalue F, Albert RK. Prone positioning in acute respiratory distress syndrome. Respir Care Clin N Am. 2003; 9 (4): 495-509. DOI: 10.1016/s1078-5337(03)00037-6.
- Alsaghir AH, Martin CM. Effect of prone positioning in patients with acute respiratory distress syndrome: a meta-analysis. Crit Care Med. 2008; 36 (2): 603–609. DOI: 10.1097/01.CCM.0000299739.98236.05.
- Sud S, Friedrich JO, Taccone P, et al. Prone ventilation reduces mortality in patients with acute respiratory failure and severe hypoxemia: systematic review and meta-analysis. Intensive Care Med. 2010; 36 (4): 585–599. DOI: 10.1007/s00134-009-1748-1.
- Gattinoni L, Carlesso E, Taccone P, et al. Prone positioning improves survival in severe ARDS: a pathophysiologic review and individual patient meta-analysis. Minerva Anestesiol. 2010; 76 (6): 448–454. Park SY, Kim HJ, Yoo KH, et al. The efficacy and safety of prone positioning in adults patients with acute respiratory distress syndrome: a meta-analysis of randomized controlled trials. J Thorac Dis. 2015; 7 (3): 356–367. DOI: 10.3978/j.issn.2072-1439.2014.12.49.
- Martin JT. Basing respiratory management of COVID-19 on physiological principles. Am J Respir Crit Care Med. 2020; 201 (11): 1319–1320. DOI: 10.1164/ rccm.202004-1076ED.
- Chesnokova N.P., Ponukalina E.V., Morrison V.V., et al. Lecture 4. Physiology of blood gases and oxygen body tissues. Nauchnoe obozrenie. Meditsinskie nauki. 2017; 2: 40–42. In Russian [Чеснокова Н.П., Понукалина Е.В., Моррисон В.В. и др. Лекция 4. Физиология транспорта газов кровью и кислородного обеспечения тканей. Научное обозрение. Медицинские науки. 2017; 2: 40–42].
- Klabunde RE. Myocardial oxygen demand. Cardiovascular Physiology Concepts. https://www. cvphysiology.com/CAD/CAD003 (14 December 2020).
- Lambermont B, Davenne E, Maclot F, et al. SARS- CoV-2 in carotid body. Intensive Care Med. 2021; 47 (3): 342–343. DOI: 10.1007/s00134-021-06351-z.
- Yaroshetskiy AI, Gritsan AI, Avdeev SN, et al. Diagnostics and intensive therapy of Acute Respiratory Distress Syndrome (Clinical guidelines of the Federation of Anesthesiologists and Reanimatologists of Russia). Russian Journal of Anaesthesiology and Reanimatology. 2020; 2: 5–39. DOI: 10.17116/anaesthesiology20200215. In Russian [Ярошецкий А.И., Грицан А.И., Авдеев С.Н. и др. Диагностика и интенсивная терапия острого респираторного дистресс-синдрома (клинические рекомендации Общероссийской общественной организации «Федерация анестезиологов и реаниматологов»). Анестезиология и реаниматология. 2020; 2: 5–39. DOI: 10.17116/ anaesthesiology20200215].
- Richardson S, Hirsch JS, Narasimhan M, et al. Presenting characteristics, comorbidities, and outcomes among 5700 patients hospitalized with COVID-19 in the New York City Area. JAMA. 2020; 323 (20): 2052–2059. DOI:10.1001/jama.2020.6775.
- Kumaraiah D, Yip N, Ivascu N, et al. Innovative ICU physician care models: COVID-19 pandemic at New York presbyterian. NEJM Catal Innov Care Deliv. 2020. DOI: 10.1056/CAT.20.0158.
- Moss M, Good VS, Gozal D, et al. An official critical care societies collaborative statement: burnout syndrome in critical care healthcare professionals: a call for action. Crit Care Med. 2016; 44 (7): 1414–1421. DOI: 10.1097/CCM.0000000000001885.
Информация об авторе:
Мазурок Вадим Альбертович, д.м.н., профессор, заведующий кафедрой анестезиологии и реаниматологии Института медицинского образования, ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России.