Перов О.И. 1, Атаманчук А.А. 2, Корнев А.И. 3, Бугровская О.И. 1, Хосровян А.М. 1, Шастина В.Р. 1, Горбатенкова С.В. 1, Горин С.Г. 1, Магеррамбейли И.Ш. 4
1 ГБУЗ «Госпиталь для ветеранов войн No 2» Департамента здравоохранения г. Москвы
2 ГБУЗ МО «Московский областной научно-исследовательский клинический институт
им. М.Ф.Владимирского», Москва
3 ФГБОУ ВО «Российский национальный исследовательский медицинский университет
имени Н.И.Пирогова» Минздрава России, Москва
4 Азербайджанский медицинский университет, Баку
В статье представлен клинический случай у пациента с пневмонией, полиорганной недостаточностью на фоне синдрома ожирения-гиповентиляции. На клиническом примере представлен опыт успешного лечения и профилактики осложнений искусственной вентиляции легких у такого пациента с применением шлема StarMed CaStar R для неинвазивной вентиляции легких.
Ключевые слова: неинвазивная вентиляция легких, деканюляция, нозокомиальная пневмония, синдром Пиквика, шлем StarMed CaStar R.
Одной из наиболее актуальных проблем современной медицины является ожирение. Распространенность его среди населения России составляет 24%, в возрастной группе 25-64 лет – 29,7%. Ожирением в настоящее время принято считать хроническое мультифакторное гетерогенное заболевание, проявляющееся избыточным образованием жировой ткани, прогрессирующее при естественном течении и, как правило, имеющее высокий кардиометаболический риск и ассоциированные с ним сопутствующие заболевания и специфические осложнения. В приведенном определении отражена существенная роль ожирения в генезе гипертонической болезни (ГБ), синдрома обструктивного апноэ сна (СОАС), сахарного диабета (СД) 2 типа, ишемической болезни сердца (ИБС). Тяжелой клинической формой этого заболевания является синдром ожирения-гиповентиляции (СОГ), получивший название «пиквикский синдром» (ПС). Название «пиквикский» вошло в историю медицины из романа Чарльза Диккенса «Посмертные записки Пиквикского клуба». В 1918 году для обозначения пациента, страдающего ожирением и гиперсомнией, это наименование впервые применил выдающийся британский врач и ученый William Osler. Спустя 40 лет Burwel C.S. представил клиническое наблюдение пациента, страдающего выраженным ожирением, ассоциированным с альвеолярной гиповентиляцией, хронической дыхательной полицитемией и признаками хронического легочного сердца, определенное им как «пиквикский синдром». В дальнейшем, Jung и Kuhl обнаружили при ПС наличие тяжелой формы СОАС. Точное количество лиц, страдающих ПС, неизвестно, но среди пациентов с ожирением и СОАС, с ПС – около 10%. Этиология развития ПС до конца не установлена, хотя существуют весомые аргументы в пользу его мультифакториальности. Признана значимой в его генезе роль полиморфизма различных генов в сочетании с алиментарным фактором. В основе патофизиологии ПС лежит ожирение, приводящее к выраженному сужению верхних дыхательных путей и инспираторному коллапсу их во время сна. Это проявляется тяжелым СОАС, со снижением вентиляционной функции, при отсутствии органического поражения легких. Нарушение вентиляции легких при ПС обусловливается механическим затруднением экскурсии диафрагмы и грудной клетки, вследствие массивного отложения жировой ткани. Отмечается также снижение максимального давления на выдохе из-за снижения силы дыхательных мышц. Мышечная слабость объясняется уменьшением податливости грудной клетки при избыточном отложении в ней жировой ткани. Тяжелые формы СОАС сопровождаются постоянной дневной сонливостью, что, например, у водителей автотранспорта, страдающих ПС, приводит к засыпанию за рулем и авариям. Нарушения вентиляции ведут к развитию гипоксии и гиперкапнии, усугубляющимися во время ночного сна. Развивается ДН с формированием «легочного сердца». Без лечения смертность при СОГ составляет около 70%.
Пациентка К., 70 лет. Жалобы на увеличение веса, одышку в покое, усиливающуюся при физической нагрузке, быструю утомляемость и постоянную сонливость на протяжении дня, отеки нижних конечностей. Свыше 20 лет страдает ожирением, ГБ, ИБС, 10 лет – СД 2 типа. Наблюдалась терапевтом, эндокринологом, кардиологом. Назначенные препараты принимала нерегулярно, предписанной диеты не придерживалась. В течение последних пяти лет неоднократно находилась на стационарном лечении по поводу декомпенсации углеводного обмена и хронической недостаточности кровообращения (НК). Настоящее ухудшение своего состояния связывала с психоэмоциональным стрессом. Ввиду прогрессирования одышки, нарастания отеков, олигурии, госпитализирована в отделение реанимации и интенсивной терапии (ОРИТ) одной и московских клиник. Там проводилась интенсивная терапия: неинвазивная вентиляция легких (НИВЛ), 3 сеанса гемодиафильтрации. Состояние улучшилось: уменьшилась ДН, восстановился диурез. Выписана. Однако, в связи с ухудшением, на следующей день госпитализирована в нашу клинику.
Состояние тяжелое. Масса тела – 165 кг, рост – 164 см, индекс массы тела – 61,35 кг/м2. Кожа лица гиперемирована, умеренный цианоз губ. Пастозность голеней и стоп. Уровень сознания по шкале комы Глазго (ШКГ) – 15 баллов. Число дыханий (ЧД) – 20 в мин, уровень насыщения кислородом гемоглобина крови (сатурация – SрО2) – 89%, при инсуффляции кислорода (О2) 4–6 л/мин SрО2 96%. Число сердечных сокращений (ЧСС) – 86 в мин, артериальное давление (АД) 140/80 мм рт. ст. Живот увеличен в размерах за счет подкожной жировой клетчатки. Диурез 150 мл/ч на фоне остаточного действия петлевых диуретиков. Анализ крови: гемоглобин (Hb) – 96 г/л, эритроциты (Э) – 3,9×1012/л, лейкоциты (Л) 15,3×109/л, общий белок – 55 г/л, креатинин – 193 мкмоль/л, глюкоза – 4,2 ммоль/л, водородный показатель (рН) – 7,47, парциальное давление углекислого газа (рСО2) – 55,9 мм рт. cт., парциальное давление кислорода (рО2) – 95,1 мм рт. cт. Рентгенография органов грудной клетки: венозное полнокровие, эмфизема с обеих сторон, гомогенное затемнение легочных полей, больше слева, за счет наличия жидкости в плевральных полостях и неоднородной инфильтрации, куполы диафрагмы не дифференцируются, срединные тени расширены (рис. 1).
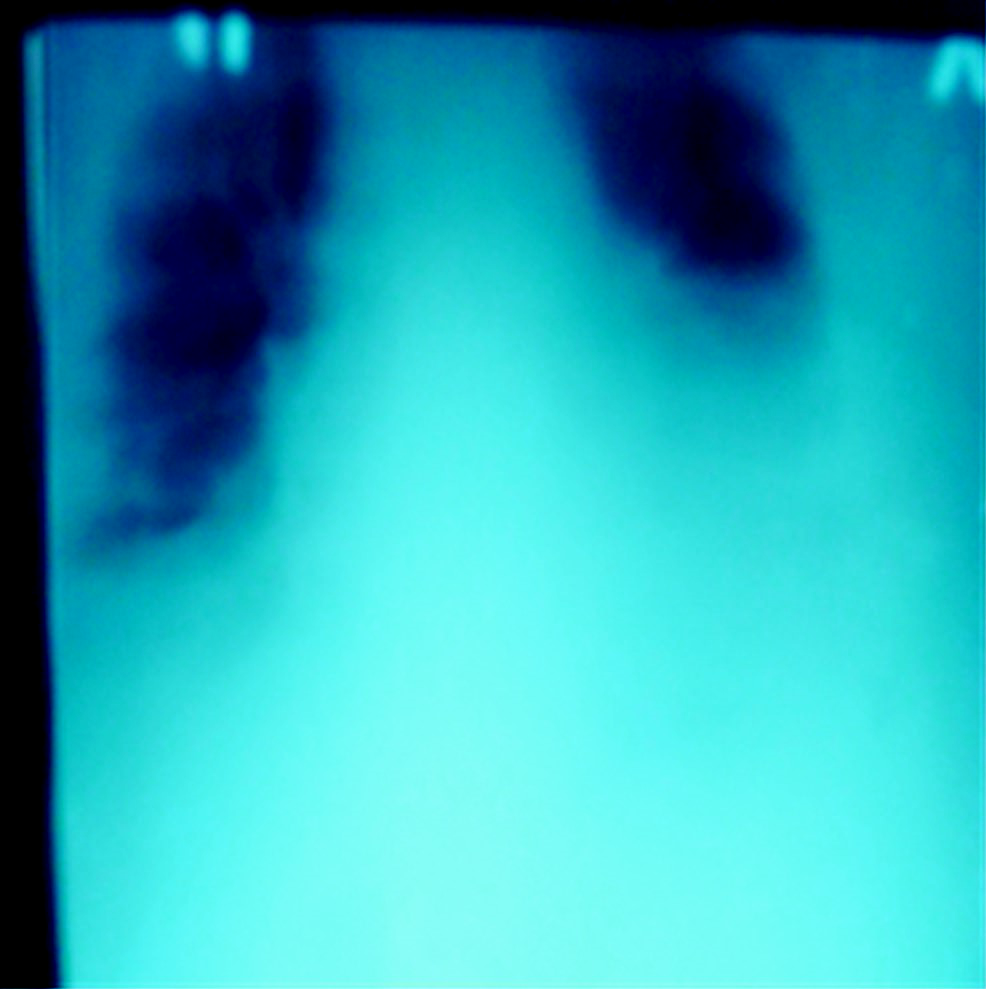
Рис. 1. Рентгенограмма органов грудной клетки больной К. до лечения
Диагноз: СОГ (ПС), нозокомиальная двухсторонняя нижнедолевая пневмония, правосторонний гидроторакс, СД 2 типа, ГБ 2 ст., артериальная гипертензия (АГ) 3 ст., риск сердечно-сосудистых осложнений 4, ИБС, атеросклеротический кардиосклероз, острая почечная недостаточность, НК 2Б ст., острая дыхательная недостаточность (ОДН).
Состояние пациентки оставалось тяжелым, с отрицательной динамикой. Уровень сознания по ШКГ – 10: сопор. Шкала сепсисобусловленной органной недостаточности (Sepsisrelated Organ Failure – SOFA) 6 баллов, рО2 100 мм рт. ст., рСО2 55 мм рт. ст. при инсуффляции О2 6 л/мин. SрО2 88%. Сердечные тоны приглушены, ритмичные, ЧСС 110-120 в мин, АД 115/70 мм рт. ст. на фоне инфузии допамина 8-10 мкг/кг/мин. Центральное венозное давление (ЦВД) 200 мм вод. ст. Ввиду прогрессирования полиорганной недостаточности (ПОН) больной произведена интубация трахеи, осуществлен перевод на искусственную вентиляцию легких (ИВЛ) респиратором «Engstrоng» в режиме синхронизированной перемежающейся принудительной вентиляции по давлению (Synchronized Intermittent Mandatory Ventilation Pressure Stated – SIMVРS). Через 3 суток выполнена трахеостомия. Параметры вентиляции: соотношение вдоха и выдоха (Inspiration:Expiration I:Е) 1:2, ЧДД 18 в мин, положительное давление в конце выдоха (Positive EndExpiratory Pressure – РЕЕР) 6 см вод. ст., давление в дыхательных путях (PS) 10 см вод. ст., фракция кислорода на выдохе (FiО2) 40%, при этом дыхательный объем (ДО) 500-550 мл, пиковое давление вдоха (Peak Inspiratory Pressure -PIP) 18 см вод. ст., среднее интегральное значение давления дыхательного цикла (Pcр) 11 см вод. ст., SрО2 94%, рО2 100 мм рт. ст., рСО2 50 мм рт. ст., индекс оксигенации (Oxygenation Index – OI) 220. ШКГ считается «золотым стандартом» в определении градации глубины комы, но оценить речевую реакцию у интубированных больных с ее помощью не представляется возможным, поэтому после интубации оценка уровня сознания проводилась нами по шкале Full Quitline of UnResponsiveness (FQUR) и составила 10 балов (сопор). Следует заметить, что первоначально нами рассматривалась НИВЛ, но уровень сознания снизился до сопора (10 баллов по ШКГ), а также пациентка была гемодинамически не стабильна, что потребовало применения вазопрессоров. Все это служило противопоказанием к проведению НИВЛ. В течение недели проводилась искусственная вентиляция легких (ИВЛ), с тенденцией к снижению респираторной поддержки до постоянного положительного давления в дыхательных путях. Параметры вентиляции: I:Е 1:2, РЕЕР 5 см вод. ст., PS 5 см вод. ст., FiО2 30%, при этом ДО 550-600 мл, PIP 14-16 см вод. ст., Pcр 10 см вод. ст., SрО2 93-94%, ЧДД 16-18 в мин, OI 367, рО2 110 мм рт. ст., рСО2 45 мм рт. ст. Проводили инфузионную, антикоагулянтную, антибактериальную (ванкомицин 1 г 2 р/сут, имипенем 1 г 2 р/сут) терапию, коррекцию гипергликемии. Состояние больной на 7 сутки – с положительной динамикой. Лабораторно: Hb 110 г/л, Э 4,3×1012/л, Л 7,2×109/л, общий белок 62 г/л, креатинин 117 мкмоль/л, глюкоза 3,9 ммоль/л, рН 7,37. Рентгенологически: количество жидкости в плевральных полостях уменьшилось, справа дифференцируется купол диафрагмы, прозрачность легочных полей увеличилась за счет уменьшения инфильтрации (рис. 2). Стало возможным проведение деканюляции и перевод на самостоятельное дыхание.
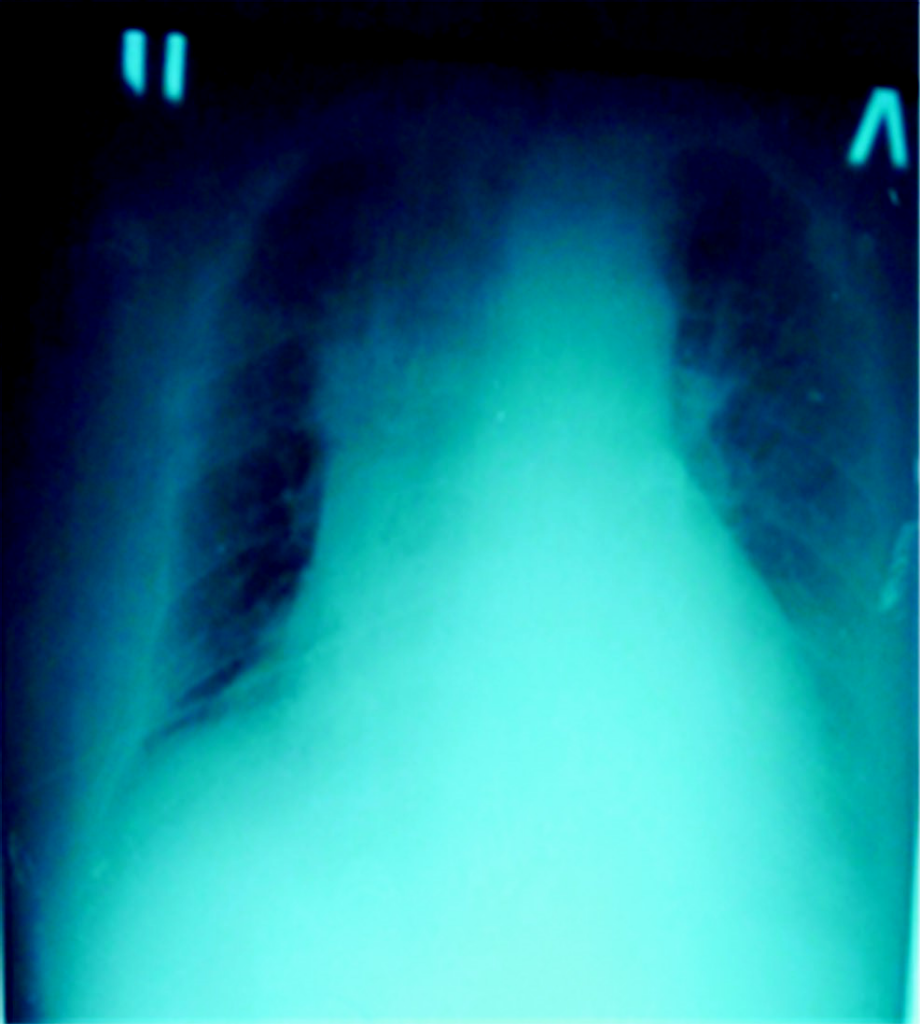
Рис. 2. Рентгенограмма органов грудной клетки больной К. в процессе лечения
Пациентка снята с ИВЛ, проводилась инсуффляция О2 4-6 л в мин. При этом развилась гипоксемия до рО2 29 мм рт. ст., гиперкапния до рСО2 55 мм рт. ст., снижение SрО2 до 88%, что затрудняло перевод на самостоятельное дыхание, а возобновление ИВЛ повышало риск развития осложнений. Проведение масочной НИВЛ стандартным оборудованием, ввиду негерметичности дыхательного контура и значительной утечки кислородно-воздушной смеси, через открытую трахеостому было клинически бесперспективно. Кроме того, известны различные осложнения, возникающие при применении стандартных масок для НИВЛ. Наиболее частыми и них являются конъюнктивиты, некрозы кожи лица, аэрофагия, транзиторная гипоксемия во время перерыва между сеансами НИВЛ. Поэтому было принято решение о применении НИВЛ с помощью шлема StarMed CaStar R (компания «Intersurgical»), который обеспечивает герметичность дыхательного контура без сдавления кожных покровов, в том числе – при изменении положения головы и тела пациента. Это согласовывалось с данными об удовлетворительной переносимости дыхательного шлема и снижении рисков, связанных с эндотрахеальной интубацией и применением лицевой маски. Шлем можно использовать в положении полусидя и лежа на спине, что создает удобство для активизации пациента. Он состоит из прозрачного пластикового цилиндра, который полностью покрывает голову больного и плотно фиксируется вокруг шеи при помощи подмышечных креплений. Преимуществом шлема является возможность обеспечения герметичного крепления неинвазивного интерфейса больным практически с любым контуром лица, отсутствие повреждений кожи. Наличие порта доступа к пациенту позволяет производить сестринские и врачебные манипуляции, не снимая шлема. После налаживания интерфейса, который закрывал своим нижним краем трахеостому, герметичность дыхательного контура была достигнута. НИВЛ проводилась респиратором «Engstrоng» в режиме вентиляции CPAP (СИПА́П – от англ. Constant Positive Airway Pressure) – режим искусственной вентиляции лёгких постоянным положительным давлением с параметрами: РЕЕР 5 см. вод. ст., FiО2 30%, сопротивление верхних дыхательных путей (Psupp) 14 см вод. ст., время нарастания 150 мс, остаточный поток 50%, триггер 3 л/мин; при этом ЧД составляла 16-18 в мин, SрО2 94-96%, OI 373 мм рт. ст., рО2 112 мм рт. ст., рСО2 46 мм рт. ст. (рис. 3). К концу третьих суток НИВЛ была прекращена, трахеостома закрылась, больная переведена на самостоятельное дыхание с инсуффляцией О2 4 л/мин. При этом рО2 125 мм рт. ст., рСО2 45 мм рт. ст., ЧДД 18-20 в мин, OI 416 мм рт. ст. Затем, в течении трех суток проводилась инсуффляция О2 со скоростью потока 4-5 л/мин, при этом SpO2 94%. В дальнейшем инсуффляция кислорода со скоростью потока 4 л/мин требовалась только в ночное время, так как SpO2 снижалась до 90% во время сна.
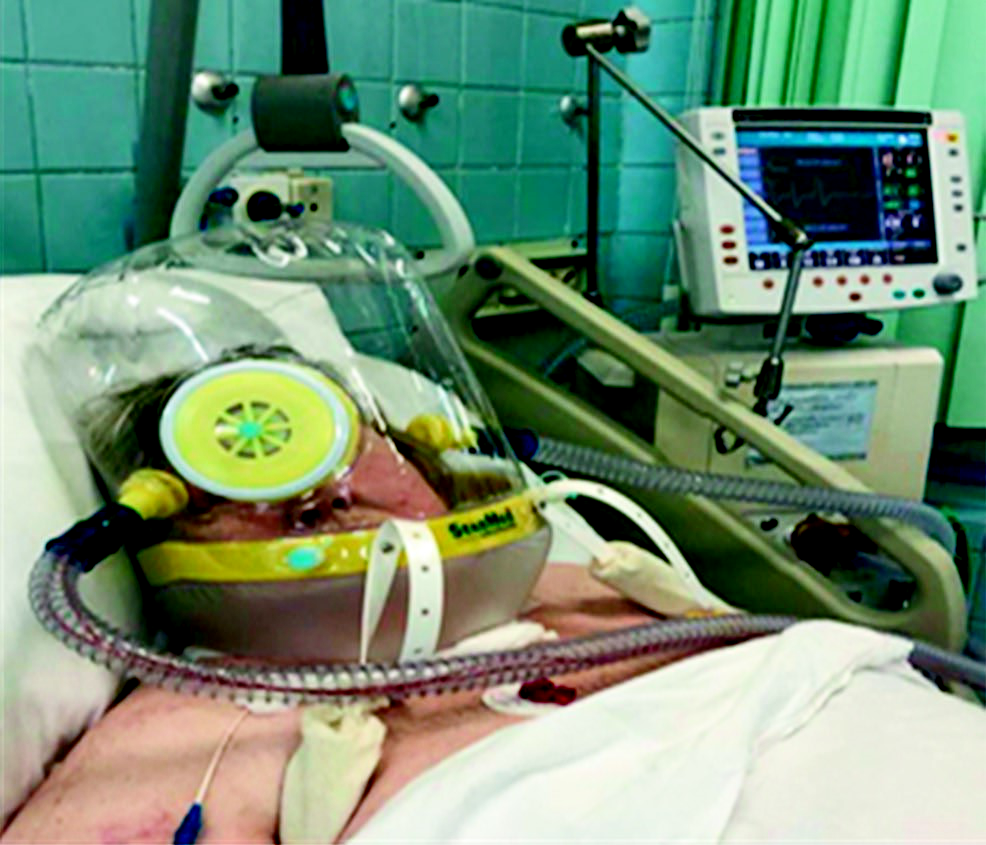
Рис. 3. Больная К. во время проведения НИВЛ с применением шлема StarMed CaStar R
Через две недели наблюдения состояние больной – удовлетворительное, SpO2 96-98% на атмосферном воздухе. С учетом разрешения пневмонии, купирования всех составляющих ПОН, клинической и лабораторной стабилизации состояния, пациентка выписана для продолжения лечения амбулаторно, включая CPAP терапию.
Заключение
Пациенты, страдающие ПС, относятся к группе лиц с высоким риском неблагоприятных исходов. Описаны клинические случаи успешного ведения пациентов с ПС и нозокомиальной пневмонией. При этом рекомендуется применение неинвазивной вентиляция легких и экстракорпоральной мембранной оксигенации (ЭКМО) в подобных ситуациях. Однако, ввиду риска развития осложнений ЭКМО, нами было принято решение в пользу искусственной вентиляции легких с последующей неинвазивной вентиляцией легких. Представленное клиническое наблюдение свидетельствует об успешном применении шлема StarMed CaStar R для НИВЛ у пациента с синдром ожирения гиповентиляции и открытой трахеостомой.
Литература
- Муромцева Г.А., Концевая А.В., Константинов В.В., Артамонова Г.В., Дупляков Д.В., Ефанов А.Ю. Распространенность факторов риска неинфекционных заболеваний в российской популяции в 2012-2013г. Результаты исследования ЭССЕ-РФ. Кардио васкулярная терапия и профилактика. 2014; 13(6):4-11.
- Ачкасов Е.Е., Рапопорт С.И., Руненко С.Д., Разина А.О. Ожирение: современный взгляд на проблему. Клиническая медицина. 2016; 94(5): 333-338.
- Любченко П.Н., Атаманчук А.А. Оценка общих и профессиональных рисков развития гипертонической болезни у рабочих машиностроительных заводов, контактирующих с вредным и производственными факторами. Альманах клинической медицины. 2012; 27:72-76.
- Атаманчук А.А., Дмитрук Л.И. Оценка риска наличия синдрома сонного апноэ среди водителей пассажирского автотранспорта в московской области. Медицина труда и промышленная экология. 2017; 9:10-11.
- Качурина К.В., Дорожкина Н.С., Сухарев В.А. Ожирение как один и предрасполагающих факторов развития синдрома Пиквика. Разбор клинического случая. Смоленский медицинский альманах. 2017;1:112-115.
- Насыбуллина Р.С., Рубанова Э.Ф., Сайфутдинов Р. Р.,Багрянова И.Д., Гваршивили Н.А., Сайфутдинов Р.Г. Клинический случай Пиквикского синдрома. Дневник казанской медицинской школы. 2013;3(3): 57-62.
- Burwell C.S., Robin E.D., Whaley R.D., Bickelmann A.G. Extreme obesity associated with alveolar hypoventilation:а Pickwickian syndrome. Am. J. Med. 1956; 21:811-818.
- Biring M.S., Lewis M.I., Liu J.T., Mohsenifar Z. Pulmonaryphysiologic changes of morbid obesity. Am. J. Med. Sci. 1999;318: 293-7.
- Chlif M.,Keochkerian D.,Mourlhon C.,Choquet D.,Ahmaidi S. Noninvasive assessment of the tension-time index of inspiratorymuscles at rest in obese male subjects. Int. J. Obes. (London),2005;. 29: 1478-83.
- Недогода С.В., Барыкина И.Н.,Саласюк А.С. Национальные клинические рекомендации по ожирению: концепция и перспективы. Вестник Волгоградского государственного медицинского университета. 2017;1 (61):134-140.
- Wijdicks E. Validation of a new coma scale:the FOUR score. Ann Neurol. 2005 Oct;58(4): 585-93.
- Авдеев С.Н. Неинвазивная вентиляция легких у пациентов с хронической обструктивной болезнью легких в стационаре и домашних условиях.Пульмонология.2017;27(2):232-249.
- Скрягин А.Е. Неинвазивная вентиляция легких: учебно-методическое пособие. Минск. БГМУ. 2011. 27с.
- Царенко С.В., Добрушина О.Р. Интенсивная терапия приобострениях хронической обструктивной болезни легких. Москва: Медицина, 2008. 105c. с илл.
- Брусенцев О.Ю., Кудин Н.К., Мигунов С.А., Семенькова Г.В. Опыт использования шлема для неинвазивной вентиляции STARMED CASTAR R у пациента с морбидным ожирением. Здравохранение Югры:опыт и инновации. 2018; 3:29-33.
- Пермякова Н.В., Долгова О.Б., Соколова С.Л., Кобелев Ю.Г. Случай смерти при синдроме Пиквика в судебно-медицинской практике. Евразийский союз ученых. 2015. №2-4(11). С. 139-142.
- Шкляев А.Е., Семеновых Е.А., Денисова Н.Ю. Возможности лечения декомпенсации хронической дыхательной недостаточности на фоне морбидного ожирения(клиническое наблюдение). Дневник казанской медицинской школы. 2018. № 4(22). С. 135-139.
- Warricker F, Islam Z, Shah BN. Lesson of the month 1. Obesity-hypoventilation (Pickwickian) syndrome: a reversible cause ofsevere pulmonary hypertension. Clin Med (London). 2017 Dec;17(6): 578-581.
- Lederer H,Stalder M,Tisljar K,Lanzi F,Landmann E,Mosimann T,Zeeh F,Zuercher S,Mosimann V,Spiegel R,Sutter R,Hunziker, P. Venovenous extracorporeal membrane oxygenation to treat hypercapnia in a morbidly obese patient. Swiss Med Wkly. 2018. Jul 12; 148: 14639.